题目内容
【题目】兴趣小组的同学利用下图装置探究工业炼铁的化学原理。

(1)实验前要先通入一氧化碳,然后再加热;实验过程中观察到硬质玻璃管内的红色物质逐渐变为_____色,写出反应的化学方程式_____。
(2)实验过程中必须对尾气进行处理,利用支架调节酒精灯的高度,用酒精灯火焰的_____点燃。
(3)通过上述实验探究,同学们总结一氧化碳的化学性质有_____。
【答案】黑 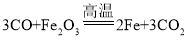 外焰 还原性、可燃性、毒性
外焰 还原性、可燃性、毒性
【解析】
(1)实验前要先通入一氧化碳,排出装置中的空气,然后再加热,防止发生爆炸;硬质玻璃管内一氧化碳和氧化铁在高温条件下反应生成铁和二氧化碳,观察到硬质玻璃管内的红色物质逐渐变为黑色,反应的化学方程式为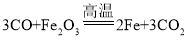 。
。
(2)实验过程中必须对尾气进行处理,利用支架调节酒精灯的高度,用酒精灯火焰的外焰点燃,外焰的温度最高,有利于一氧化碳的点燃。
(3)由实验可知一氧化碳能与氧化铁反应生成铁和二氧化碳,体现了一氧化碳的还原性。实验过程必须对尾气进行处理,是因为一氧化碳有毒,会污染环境。用燃烧法进行尾气处理,说明一氧化碳具有可燃性。

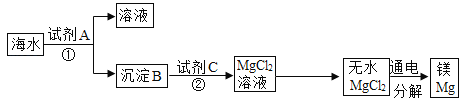
【题目】用某矿石(主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质)制取MgO的工艺流程简图如图:
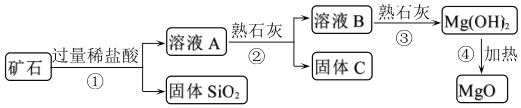
回答下列问题:
(1)步骤①和步骤②均用到的操作是_____。
(2)溶液A一定_____ (填“有”或“没有”)颜色,其中所含质量最小的阳离子是_____(填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的pH | 3.2 | 6.7 | 11.1 |
步骤②加入熟石灰,调节溶液的pH范围为_____,固体C中所含成分的化学式为_____。
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如图所示。则在上述流程步骤④中,加热的温度至少_____℃以 上,图中拐点的X值为_____(取整数)。

(5)写出步骤①中Fe2O3溶于盐酸的反应化学方程式:_____。
(6)上面工业流程中不用石灰水代替熟石灰工业意义是:_____(答一条即可)。