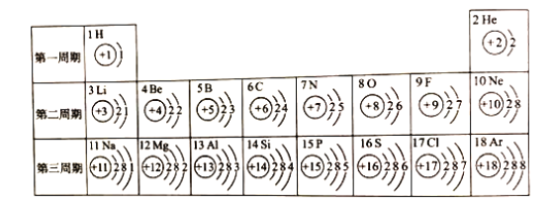
题目内容
【题目】用某矿石(主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质)制取MgO的工艺流程简图如图:
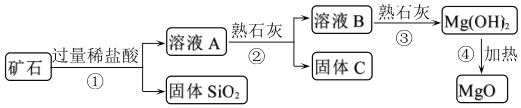
回答下列问题:
(1)步骤①和步骤②均用到的操作是_____。
(2)溶液A一定_____ (填“有”或“没有”)颜色,其中所含质量最小的阳离子是_____(填离子符号)。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子 | Fe3+ | Cu2+ | Mg2+ |
开始沉淀时的pH | 1.9 | 4.2 | 9.1 |
完全沉淀时的pH | 3.2 | 6.7 | 11.1 |
步骤②加入熟石灰,调节溶液的pH范围为_____,固体C中所含成分的化学式为_____。
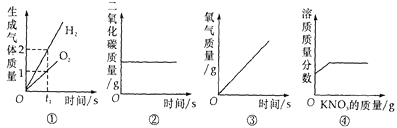
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如图所示。则在上述流程步骤④中,加热的温度至少_____℃以 上,图中拐点的X值为_____(取整数)。

(5)写出步骤①中Fe2O3溶于盐酸的反应化学方程式:_____。
(6)上面工业流程中不用石灰水代替熟石灰工业意义是:_____(答一条即可)。
【答案】过滤 有 H+ 6.7~9.1 Cu(OH)2和Fe(OH)3 350 69 Fe2O3+6HCl═2FeCl3+3H2O 氢氧化钙微溶于水,饱和石灰水是稀溶液,用熟石灰粉末把金属离子转化成沉淀的效果更好
【解析】
(1)过滤可以将不溶性固体从溶液中分离出来,所以步骤①和步骤②均用到的操作是过滤,故填过滤。
(2)步骤①中盐酸和氧化铁反应生成氯化铁和水,盐酸和氧化铜反应生成氯化铜和水,盐酸和氧化镁反应生成氯化镁和水,由于溶液A中含有氯化铁和氯化铜,所以溶液A一定有颜色,故填有;
步骤①盐酸是过量的,所以溶液A中所含质量最小的阳离子是氢离子,其符号为H+,故填H+。
(3)由铁离子、铜离子沉淀时的pH和镁离子开始沉淀的pH可知,步骤②加入熟石灰,应调节溶液的pH范围为6.7~9.1,避免镁离子形成氢氧化镁沉淀,故填6.7~9.1;
由图可知,固体C中所含成分是氢氧化铜和氢氧化铁,其化学式为Cu(OH)2、Fe(OH)3,故填Cu(OH)2、Fe(OH)3。
(4)由加热温度与固体残留率的关系图可知,则在上述流程步骤④中,加热的温度至少350℃以上,故填350;
有图可知,当温度为350℃时,氢氧化镁全部转化为氧化镁,根据化学方程式Mg(OH)2![]() MgO+H2O可知,每58份质量的氢氧化镁完全分解可生成40份的氧化镁,则固体残留率=
MgO+H2O可知,每58份质量的氢氧化镁完全分解可生成40份的氧化镁,则固体残留率=![]() ×100%≈69%,所以图中拐点的X值为69,故填69。
×100%≈69%,所以图中拐点的X值为69,故填69。
(5)步骤①中Fe2O3与盐酸生成了氯化铁和水,故反应的化学方程式写为:Fe2O3+6HCl═2FeCl3+3H2O。
(6)由于氢氧化钙微溶于水,上面工业流程中不用石灰水代替熟石灰工业意义是:氢氧化钙微溶于水,饱和石灰水是稀溶液,用熟石灰粉末把金属离子转化成沉淀的效果更好。

 字词句段篇系列答案
字词句段篇系列答案【题目】在宏观、微观和符号之间建立联系是化学学科的特点。高温下,甲和乙反应生成丙和丁,结合表中信息判断下列说法正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
|
化学式 | ? | C | CO | H2 | |
微观 示意图 |
|
|
| ? |
A. 甲的化学式为CO2 B. 保持丙化学性质的最小粒子为碳原子和氧原子
C. 反应物和生成物中都有化合物 D. 反应生成丙与丁的分子个数比为2:1