题目内容
【题目】海水是一种重要的自然资源。以下是对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是____法。
(2)从海水中获得氯化钠.将海水进行_____可得到粗盐。
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程:
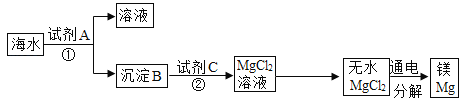
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为___,由无水MgCl2制取Mg的化学方程式为______。海水本身是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:__________。
【答案】蒸馏 蒸发结晶 Mg(OH)2 MgCl2![]() Mg+Cl2↑ 通过得到的MgCl2浓度更大,纯度更高
Mg+Cl2↑ 通过得到的MgCl2浓度更大,纯度更高
【解析】
(1)从海水中获取淡水,是将海水中的盐和难溶性杂质全部除去的过程,可以采用蒸馏的方法得到纯净的淡水,故填蒸馏。
(2)氯化钠的溶解度受温度影响较小,所以从海水中通过结晶的方法获得氯化钠宜采用蒸发结晶的方法,故填蒸发结晶。
(3)从海水中提取金属镁,先将石灰乳(主要成分是氢氧化钙)与海水混合,其中的反应是海水中的氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀,所以沉淀B为氢氧化镁。其化学式为Mg(OH)2,故填Mg(OH)2;
由图可知,无水MgCl2制取Mg的反应是无水氯化镁在通电的条件下反应生成镁和氯气,故反应的化学方程式写为:MgCl2![]() Mg+Cl2↑;
Mg+Cl2↑;
海水中除含有氯化镁外,还有其它杂质,且有些杂质的含量比氯化镁的含量高,而通过步骤①、②得到的MgCl2溶液中氯化镁的含量高,且不含其它杂质,即氯化镁的纯度高,故填通过得到的MgCl2浓度更大,纯度更高。

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目