题目内容
【题目】常用仪器的使用、常见气体的制取是初中化学实验的基础内容。如图是实验室常用的仪器,请回答下列问题:
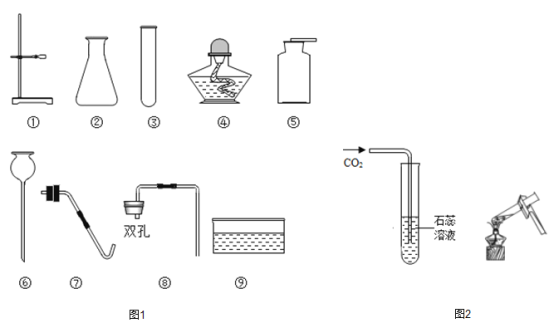
(1)写出图1中标号④的仪器名称_____________。
(2)若要组装一套用高锰酸钾制取并收集氧气的装置,可选择的仪器组合为_________(填序号),该装置中还需要的种实验用品是_________,发生反应的化学方程式为__________,实验中有些错误操作可能会使试管炸裂,写出为避免试管炸裂的一个操作___________。
(3)实验室制取二氧化碳选用的药品是___________(填名称),一般不用排水法收集二氧化碳的原因是_______。实验结束后,小静发现试管内仍有固体剩余,她处理的办法是_______________。
(4)某同学利用如图2装置进行二氧化碳的性质探究实验时,将制得的二氧化碳通入紫色石蕊溶液中,溶液变红,但将变红的溶液加热时,溶液没有变紫色。于是小组同学对产生该现象的原因进行了下列探究。
(提出猜想)猜想①:紫色石蕊溶液已变质;猜想②:二氧化碳中混有较多氯化氢。
同学们经过讨论后很快就排除了猜想①,其原因是_________。
(设计实验)请设计实验验证猜想②正确。
实验操作 | 实验现象 |
_______ | _______ |
(5)实验室可以用草酸脱水的方法来制取氧化碳,反应原理如下: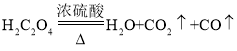 ,为获得较纯净的一氧化碳,可采取___________方法净化。
,为获得较纯净的一氧化碳,可采取___________方法净化。
【答案】酒精灯 ①③④⑤⑦⑨ 棉花 ![]() 加热时试管口略向下倾斜(合理即可) 石灰石(或大理石)和稀盐酸 二氧化碳能溶于水并能与水反应 将试管内的废液倒入废液缸,再用水清洗剩余固体,放入指定容器内 若紫色石蕊溶液变质,通入二氧化碳后溶液不会变红色 取少量红色溶液于试管中,滴加少量的稀硝酸和硝酸银溶液 产生白色沉淀 将混合气体依次通过氢氧化钠溶液、浓硫酸(合理即可)
加热时试管口略向下倾斜(合理即可) 石灰石(或大理石)和稀盐酸 二氧化碳能溶于水并能与水反应 将试管内的废液倒入废液缸,再用水清洗剩余固体,放入指定容器内 若紫色石蕊溶液变质,通入二氧化碳后溶液不会变红色 取少量红色溶液于试管中,滴加少量的稀硝酸和硝酸银溶液 产生白色沉淀 将混合气体依次通过氢氧化钠溶液、浓硫酸(合理即可)
【解析】
根据常用仪器的使用规则、常见气体的制取的一般思路作答。
(1)仪器④为酒精灯。
(2)实验室用高锰酸钾制取氧气为固体加热型,氧气不易溶于水可用排水法收集,发生和收集装置需要的仪器是①③④⑤⑦⑨;为避免高锰酸钾粉末进入导管造成堵塞,应在试管口加一团棉花;为避免试管炸裂,试管口应略向下倾斜或先预热再集中加热,或实验结束时,先将导管从水槽中取出,再熄灭酒精灯。
(3)实验室常用石灰石或大理石和稀盐酸反应制取二氧化碳,由于二氧化碳能溶于水并能与水反应,故一般不用排水法收集二氧化碳,处理剩余固体的方法是将试管内的废液倒入废液缸,再用水清洗剩余固体,放入指定容器内。
(4)[提出猜想]
二氧化碳和水反应产生碳酸,碳酸显酸性,能使紫色石蕊溶液液变成红色;将制得的二氧化碳通入紫色石蕊溶液中,溶液变红,说明紫色石蕊溶液没有变质;
[设计实验]
由于猜想②正确,即溶液中有氯化氢,氯化氢能和硝酸银溶液反应生成不溶于稀硝酸的氯化银白色沉淀,所以取少量红色溶液于试管中,滴加少量的稀硝酸和硝酸银溶液,会产生白色沉淀。
(5)草酸分解制得的一氧化碳中含有二氧化碳和水蒸气,可将混合气体通过氢氧化钠溶液除去二氧化碳,再通过浓硫酸,除去水蒸气,即可得到纯净的一氧化碳,或直接通过碱石灰也可达到目的。

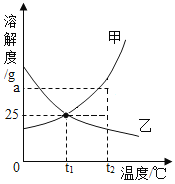
【题目】研究性学习小组选择“过氧化氢分解生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程。
(提出猜想)过氧化氢分解生成氧气的快慢与催化剂的种类有关。
(实验方案)常温下,取两份体积相同、浓度相同的过氧化氢溶液,分解加入二氧化锰和红砖粉末,测定各收集一瓶(体积相同)氧气所需要的时间。
(进行实验)实验装置如图所示,组装好实验装置后,首先要_______________,再将分液漏斗中的液体加入锥形瓶中,立即收集一瓶气体,此实验中宜采用的收集气体的方法是____________。
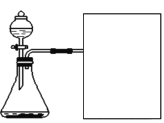
(实验记录)
试验编号 | ① | ② |
反应物 | 5%过氧化氢溶液50g | 5%过氧化氢溶液50g |
催化剂 | 红砖粉末 | 1g二氧化锰 |
收集气体所需时间 | 165s | 46s |
实验①中加入红砖粉末的质量是__________ g。
(得出结论)该探究过程得出的结论是____________________。
(反思)过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉末后分解速率明显加快,若要证明二氧化锰和红砖粉末是否为该反应的催化剂,还需要增加实验来验证它们在化学反应前后的 __________和________是否改变。