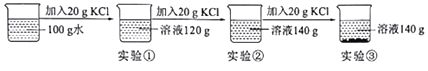
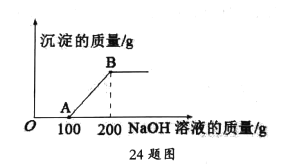
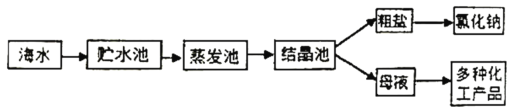
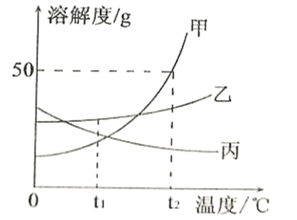
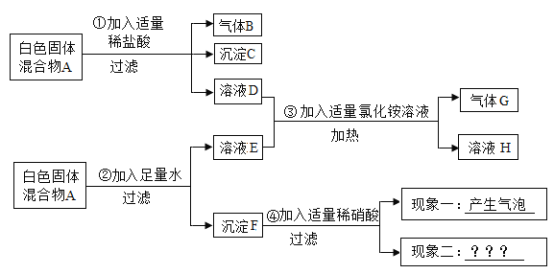
题目内容
【题目】高氯酸钾![]() 是一种性能稳定的物质,主要用作发烟剂、引火剂、氧化剂和化学分析试剂,工业生产上生产的高氯酸钾的工艺流程如图:
是一种性能稳定的物质,主要用作发烟剂、引火剂、氧化剂和化学分析试剂,工业生产上生产的高氯酸钾的工艺流程如图:
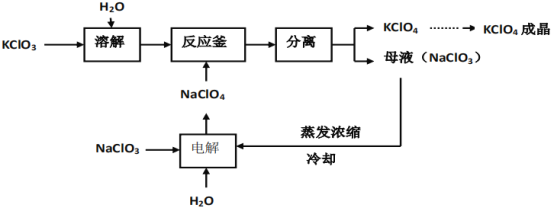
回答下列问题:
(1)为加快氯酸钾的溶解,可采取的措施为_____。
(2)流程中的分离操作相当于实验室中的____。
(3)反应釜中发生的化学反应方程式为_____,该反应属于基本反应类型中____的反应。
(4)电解NaClO3溶液时,除产生NaClO4外,还得到一种清洁的高能燃料,该反应的化学方程式为_____。
【答案】搅拌、加热等 过滤 ![]() 复分解反应
复分解反应 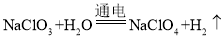
【解析】
(1)为加快氯酸钾的溶解,可采取的措施为搅拌、加热等。
(2)流程中的分离操作能将固液分离,该操作相当于实验室中的过滤。
(3)由流程中物质的变化可知,反应釜中发生的化学反应方程式为:![]() ,该反应由两种化合物相互交换成分生成了两种新的化合物,属于基本反应类型中的复分解反应。
,该反应由两种化合物相互交换成分生成了两种新的化合物,属于基本反应类型中的复分解反应。
(4)电解NaClO3溶液时,除产生NaClO4外,还得到一种清洁的高能燃料,由质量守恒定律可知,反应物中含Na、Cl、O,H,故该清洁的高能燃料是氢气,故反应的化学方程式为: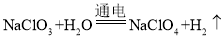 。
。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案【题目】A B C D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。下列说法不正确的是
物质 | A | B | C | D |
|
微观示 意图 |
|
|
|
|
A.B的化学式为SO2
B.生成的C为单质
C.参加反应的A和B分子个数比为2:1
D.16gB参加反应,则生成C的质量为8g
【题目】取20g碳酸钠和碳酸氢钠的固体混合物,加热至不再产生气体2NaHCO3![]() Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 |
仪器和浓硫酸的质量总和(g) | 150 | 150.9 | 151.8 | 151.8 |
(1)当完全反应后,生成水的质量为_____g。
(2)计算混合物中碳酸氢钠的质量分数________。(要求写出计算过程)
(3)将上述混合物完全分解后的固体溶解于186.2g 水中,待固体完全溶解后所得溶液中溶质的质量分数为_____。