题目内容
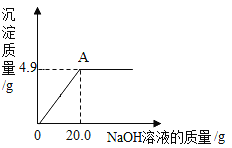
【题目】在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示:
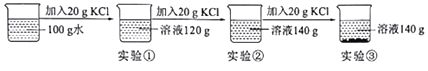
(1)该温度下,实验①所得溶液是______溶液![]() 填“饱和”或“不饱和”
填“饱和”或“不饱和”![]() 。
。
(2)该温度下,KCl的溶解度为______。
(3)实验③所得溶液中溶质的质量分数是______。![]() 填选项序号
填选项序号![]() 。
。
a.40% b.37.5% c.28.6%
【答案】不饱和 40g c
【解析】
饱和溶液是指一定温度下不能继续溶解某种溶质的溶液,固体的溶解度是指一定温度下100g溶剂水中达到饱和状态所溶解的这种溶质的质量就是该温度下该物质在水中的溶解度。
(1)饱和溶液是指一定温度下不能继续溶解某种溶质的溶液,①能继续溶解这种溶质,故该温度下,实验①所得溶液是不饱和溶液![]() 填“饱和”或“不饱和”
填“饱和”或“不饱和”![]() 。
。
(2)实验②、③溶液的质量均为140g,100g水中加入了2次氯化钾固体,每次加入20g氯化钾即共40g氯化钾后所得溶液不能再溶解氯化钾,则该温度下100g水中加入40g氯化钾正好饱和,故该温度下氯化钾的溶解度是40g。
(3)根据图示可知100g水中加入60g氯化钾所得溶液质量为140g,说明只溶解了40g,所以该温度下的溶解度是40g;故实验③溶液的质量分数为![]() ,故选c。
,故选c。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】胃酸过多须服用抗酸药物(能与盐酸反应),常用的抗酸药物有碳酸氢钠片、铝碳酸镁片,兴趣小组的同学对这两种药物开展如下探究。
(查阅资料)①铝碳酸镁片的主要成分的化学式为AlMg(OH)3CO3;
②抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子。结合上述知识分析,该药物起抗酸作用的微粒是_____(填化学符号)。
(2)小王取一定量碳酸氢钠片与4mLpH═1的稀盐酸(模拟胃酸)反应。药片中其他成分不溶于水也不参加反应。他对反应后溶液的成分产生了兴趣。
(作出猜想)
猜想 1:只含 NaCl;
猜想 2:_____;
猜想 3:NaCl、NaHCO3
(设计实验)
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 取一定量反应后的溶液于试管中,滴加_____ | 无明显现象 | 猜想 3错误 |
实验二 | 另取一定量反应后的溶液于试管中,______ | ______ | 猜想 2正确 |
实验二中涉及反应的化学方程式为______。
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生 CO2的速率快慢和中和酸的能力强弱。
如图 1,利用数字化实验分别测定碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生 CO2的速率快慢和 pH的变化,得到“二氧化碳浓度与时间”曲线(如图 2)、“pH与时间”曲线(如图 3)。
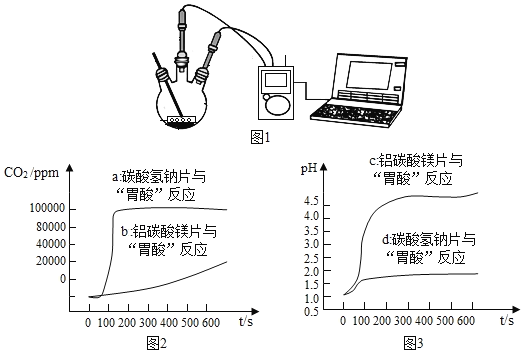
(1)服用碳酸氢钠片更易造成胃胀气,原因是_____。
(2)铝碳酸镁片中和酸的能力更强,理由是_____。
(反思与提升)日常生活中,我们应该根据个人的具体病情,选择合适种类的胃药。