题目内容
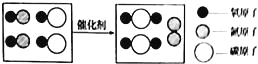
【题目】从微观的角度分析并解释下列事实,确的是![]()
![]()
选项 | 事实 | 解释 |
A | 气球易被压缩,钢球受压后却纹丝不动 | 粒子的硬度不同 |
B | 端午时节粽飘香 | 粒子在不断运动着 |
C | 湿衣服在阳光下比在阴凉处干得快 | 温度升高,粒子自身体积增大 |
D | 用扫描隧道显微镜可获得苯分子的图象 | 粒子大,可用肉眼直接观察 |
A. A B. B C. C D. D
【答案】B
【解析】
A、气球易被压缩,钢球受压后却纹丝不动是因为气体粒子间隔比固体的分子间隔大,故A错误;
B、端午时节粽飘香,是因为粒子在不断运动着的缘故,故B正确;
C、湿衣服在阳光下比在阴凉处干得快,是因为阳光下温度高,温度升高,粒子运动速率加快,粒子自身体积没有改变,故C错误;
D、用扫描隧道显微镜可获得苯分子的图像,是因为放大倍数大缘故,粒子很小不可能用肉眼直接观察,故D错误。 故选B。

【题目】铁是世界上年产量最高的金属,铁及其合金也是应用最广泛的金属材料。请根据我们所学的有关金属的知识回答问题:
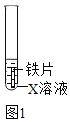
(1)验证金属的活动性(实验装置如图1)
①若要证明Fe在金属活动性顺序中位于氢前,X溶液可选用______,其现象为______。
②若X溶液为少量硫酸铜溶液,该反应的化学方程式为______。待充分反应后,取出铁片,放入金属R,观察到R表面有黑色固体析出。根据上述实验现象,得出Fe、Cu、R的金属活动性顺序为______。
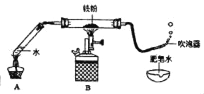
(2)某纯净气体通过如图2装置时,可观察到:A中紫色石蕊试液不变色,C中澄清石灰水变浑浊。请按要求回答问题:
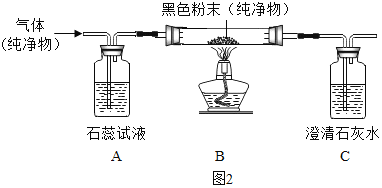
①纯净气体可以是CO.若黑色固体为______,反应过程中B处可以观察到黑色固体______的明显实验现象。
②纯净气体可以是CO.但B处无明显实验现象,则B处发生反应的化学方程式为______。
③纯净气体和黑色固体的组合还可以是______,则B处的实验现象为______。
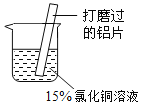
(3)铝是地壳中含量最高的金属元素。某小组同学在实验室研究铝与氯化铜溶液的反应液的反应。
实验操作 | 实验现象 |
| A.红色物质附着于铝片表面 B.铝片表面逸出大量无色气体,放出大量的热 C.烧杯底部出现红色沉淀和白色沉淀 |
①现象A和现象C中的红色物质均为Cu,生成该物质的化学方程式为______。
②经检验,现象B中的无色气体为氢气。甲同学猜测可能是氯化铜溶液显酸性。经实验检测,证实了甲的猜想。
③探究白色沉淀的化学成分。
(推理猜想)
乙同学通过查阅资料认为白色沉淀可能是氯化亚铜(CuCl)。
(查阅资料)
★CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-
★Cu(NH3)2+在空气中易被氧化变为蓝色:Cl-可与硝酸银溶液反应,产生白色沉淀。
(进行实验)
步骤一:取烧杯底部的白色沉淀,充分洗涤;
步骤二:向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
步骤三:取其中一份无色溶液……
步骤四:将另一份无色溶液放置于空气中……
以上步骤三的实验方案是______;
步骤四的现象是______。
(得出结论)通过实验可以确定,该白色固体是CuCl。
(反思与评价)A和CuCl2溶液反应为什么会出现CuCl呢?
丙同学猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
丙同学为了验证猜想,取Cu粉与15%CuCl2溶液混合,无白色沉淀产生。
④丙通过分析Al与CuCl2溶液反应的实验现象,改进了实验,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是______。
⑤丁同学认为丙同学的实验还不够严谨,还应考虑______对Cu与CuCl2溶液反应的影响。