题目内容
【题目】某兴趣小组在老师的指导下,对铁与水蒸气的反应中所得产物展开探究:
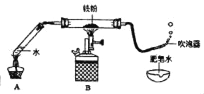
(实验初探)①组装如图所示装置并检查气密性;②装入药品并固定;③加热一段时间后,B中固体颜色无明显变化,但吹泡器连续吹出气泡,且气泡向上飞起,用燃着的木条靠近气泡,能产生爆鸣。证明该气体为______。
(查阅资料)常见的铁的氧化物有三种(FeO、Fe2O3、Fe3O4)
①三种氧化物中FeO、Fe3O4均为黑色;
①三种氧化物都不溶于水,其中铁粉、Fe3O4能被磁铁吸引
②三种氧化物都不与硫酸铜溶液反应,但能与酸反应生成可溶性物质。
(产物分析)实验小组同学对反应后玻璃管内的剩余固体进行探究。
①甲同学发现固体仍为黑色,由此判断:固体中肯定不存在Fe2O3,理由是______。
②乙同学发现固体能全部被磁铁吸引,且黑色固体中一定没有______。
(作出猜想)猜想I:全是Fe;猜想Ⅱ:全是Fe3O4;猜想Ⅲ:______;
(定性探究)小组同学准确称取20g固体于试管中进行实验,加入过量______溶液,出现红色固体,且有黑色固体残留。出现红色固体的化学方程式是______,猜想______成立,故铁与水蒸气发生置换反应的方程式是______。
(定量测定)小组同学继续将上述定性探究实验后试管内的剩余物过滤、洗涤、干燥,称得固体质量为20.4g,则铁与水蒸气反应后玻璃管内固体中:剩余铁单质的质量为______g(请写出此问解题过程),Fe3O4的质量分数为______。
(实验反思)若定量测定中进行“干燥”操作时,将所得固体于空气中加热烘干,则会导致所得Fe3O4的质量分数______(填“偏大”、“偏小”或“不变”)。
【答案】氢气 氧化铁是红色固体 氧化亚铁 Fe、Fe3O4 硫酸铜 Fe+CuSO4=FeSO4+Cu Ⅲ 3Fe+4H2O![]() Fe3O4+4H2 2.8 86% 偏小
Fe3O4+4H2 2.8 86% 偏小
【解析】
[实验初探]气泡向上飞起,说明气体密度比空气小,用燃着的木条靠近气泡,能产生爆鸣,说明气体具有可燃性,证明该气体为氢气;
[产物分析]①固体中肯定不存在Fe2O3,理由是氧化铁是红色固体;
②乙同学发现固体能全部被磁铁吸引,且黑色固体中一定没有氧化亚铁,这是因为氧化亚铁不能被磁铁吸引;
[作出猜想]猜想I:全是Fe;猜想Ⅱ:全是Fe3O4;猜想Ⅲ:Fe、Fe3O4;
[定性探究]小组同学准确称取20g固体于试管中进行实验,加入过量硫酸铜溶液,出现红色固体,是因为铁和硫酸铜反应生成硫酸亚铁和铜,且有黑色固体残留,说明固体中含有四氧化三铁,出现红色固体的化学方程式是:Fe+CuSO4═FeSO4+Cu;
猜想Ⅲ成立,故铁与水蒸气发生置换反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O![]() Fe3O4+4H2;
Fe3O4+4H2;
[定量测定]设铁质量为x,

![]()
x=2.8g,
Fe3O4的质量分数为:![]() ×100%=86%,
×100%=86%,
[实验反思]若定量测定中进行“干燥”操作时,将所得固体于空气中加热烘干时,铜能和氧气反应生成氧化铜,导致计算的铁的质量偏大,从而导致所得Fe3O4的质量分数偏小。

 走进文言文系列答案
走进文言文系列答案【题目】某兴趣小组通过镁与稀盐酸反应探究影响反应速率的因素(镁的质量相等,镁条的形状一样,稀盐酸均过量),设计实验如表:
实验编号 | 盐酸的质量分数 | 镁的形态 | 溶液初始温度/℃ |
① | 3% | 粉末 | 30 |
② | 3% | 条状 | 20 |
③ | 6% | 粉末 | 20 |
④ | 6% | 条状 | 20 |
(1)镁与稀盐酸反应的化学方程式为______。
(2)若四组实验均以收集到250mL氢气为标准,要比较各组反应速率,则以上实验还需要测出的数据是______。
(3)实验______和______(填实验编号)是研究盐酸的浓度对该反应速率的影响。
(4)测定在不同时间产生的氢气的体积数据,绘制出图1,则实验②对应的曲线可能是______(填序号)。
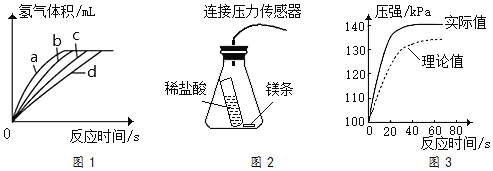
(5)利用图2压力传感器进行实验,得到图3锥形瓶内的压强随时间变化的曲线图,发现实验测得的实际值比理论值偏大。请分析可能的原因______。
【题目】从微观的角度分析并解释下列事实,确的是![]()
![]()
选项 | 事实 | 解释 |
A | 气球易被压缩,钢球受压后却纹丝不动 | 粒子的硬度不同 |
B | 端午时节粽飘香 | 粒子在不断运动着 |
C | 湿衣服在阳光下比在阴凉处干得快 | 温度升高,粒子自身体积增大 |
D | 用扫描隧道显微镜可获得苯分子的图象 | 粒子大,可用肉眼直接观察 |
A. A B. B C. C D. D