题目内容
【题目】向硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为 m 的锌粉,溶液中析出 固体的质量与参加反应的锌粉质量关系如图所示:
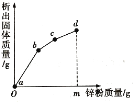
(1)写出 ab 段发生反应的化学方程式。________________
(2)C 点对应的溶液中含有的金属离子是什么?________________
(3)为什么关系图中 bc 段斜率小于 ab 段?________________
【答案】Zn+2AgNO3=Zn(NO3)2+2Ag Zn2+和Fe2+ 因为每65份质量的锌会置换出216份质量的银,会置换出64份质量的铜,所以关系图中 bc 段斜率小于 ab 段
【解析】
根据金属活动性顺序,由图可知,ab段(不含两端点)为锌与硝酸银的反应,b点硝酸银溶液刚好完全反应;bc段(不含两端点)为锌与硝酸铜的反应,析出的是铜;cd段(不含两端点)为锌与硝酸亚铁反应。
(1)ab段(不含两端点)为锌与硝酸银的反应方程式为Zn+2AgNO3=Zn(NO3)2+2Ag;
(2)C点对应溶液是锌与硝酸银和硝酸铜完全反应时的溶液,其中含有的金属离子为Zn2+和Fe2+
(3)ab段(不含两端点)为锌与硝酸银的反应,bc段(不含两端点)为锌与硝酸铜的反应,每65份质量的锌会置换出216份质量的银,会置换出64份质量的铜,所以关系图中 bc 段斜率小于 ab 段。

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目