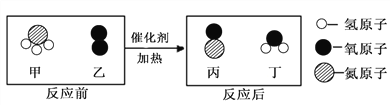
题目内容
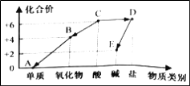
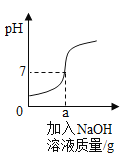
【题目】用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如图所示。请计算
(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水_____克。
(2)当a为80g时,所得溶液中溶质的质量分数是多少____________(结果精确到0.1%)?
【答案】 50 克。 3.8%。
【解析】本题考查了溶液的稀释和根据化学方程式的计算。认真审题,使用正确的数据。
(1) 设需要水的质量为x ,根据溶质在稀释前后质量不变。
100g×5%=(100g-x)×10% x=50g;
(2)根据图像可知,当a为80g时,盐酸与氢氧化钠恰好完全反应。
设:80g氢氧化钠与73g盐酸反应生成的氯化钠的质量为y。
NaOH+ HCl =NaCl+H2O
40 58.5
80g×5% y
![]() y=5.85g
y=5.85g
反应后所得溶液中溶质的质量分数=![]() ×100%=3.8%。
×100%=3.8%。

 寒假学与练系列答案
寒假学与练系列答案【题目】某化学兴趣小组的同学做完“大理石和稀盐酸制取二氧化碳的实验”后,将反应后锥形瓶中残留的废液过滤,并对滤液进行探究(已知大理石中所含杂质既不溶于水,也不与酸反应)。
(提出问题)滤液中所含溶质是什么?
(查阅资料)氯化钙溶液呈中性
(猜想与假设)
猜想1:滤液中的溶质可能是CaCl2和CaCO3
猜想2:滤液中的溶质只有CaCl2
猜想3:滤液中的溶质是_______。
(讨论与交流)
小明认为猜想1无需验证就知道是错误的,他的理由是__________。
(实验与结论)
(1)小亮同学为验证猜想2,取少量滤液装入试管中,然后滴入酚酞溶液,发现酚酞溶液不变色,于是小亮认为猜想2正确。你认为他的结论_______(填“正确”或“错误”),理由是_______。
(2)小美为验证猜想3,用洁净干燥的玻璃棒蘸取该滤液滴到湿润的pH试纸上,测得pH=4,她认为猜想3正确。对她的操作方法、测量结果及结论的评价,正确的是______。
A.方法不正确,结果偏小,结论正确 B.方法正确,结果偏大,结论不正确
C.方法不正确,结果偏大,结论正确 D.方法正确,结果偏小,结论不正确
(3)小丽使用了几种物质类别不同的物质来验证猜想3,也得出了结论,请完成下表:
方案 | 使用的试剂 | 实验现象 | 结论 |
A | 石蕊溶液 | 溶液变红 | 猜想3正确 |
B | 镁条 | __________ | |
C | 氧化铁 | _________ | |
D | _____ | 固体溶解,溶液变成蓝色 | |
E | 硝酸银溶液 | 产生白色沉淀 |
(反思与评价)上述方案有错误及错误的原因是________、___________(填写错误方案的序号,并解释其错误的原因)。
(拓展与延伸)若猜想3成立,小聪认为无需另加试剂,只要对滤液进行_______操作即可除去杂质,得到CaCl2固体。
(4)小明同学向一定质量的上述猜想3滤液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。问:
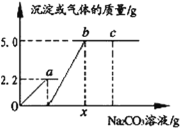
①图中oa段表示生成_______(“气体”还是“沉淀”)的过程;
②a点溶液中溶质为_________;
③c点溶液的pH_____7(填>、<、=);
④x值是_________?(写出具体的计算过程)
【题目】一些食物的近似pH如下:
食物 | 葡萄汁 | 苹果汁 | 牛奶 | 鸡蛋清 |
pH | 3.5~4.5 | 2.9~3.3 | 6.3-6.6 | 7.6~8.0 |
下列说法正确的是
A. 鸡蛋清和牛奶显碱性 B. 要补充维生索可以多吃鸡蛋清
C. 苹果汁的酸性比葡萄汁弱 D. 胃酸过多的人应少饮葡萄汁和苹果汁
【题目】某化学兴趣小组的同学对一份固体样品进行了探究。通过实验已确定该样品由氧化铁和铁粉混合而成。他们称取了13.6g固体样品,用下图所示的装置继续实验,完全反应后,测定的有关数据如下表所示。
A中固体 的质量 | 澄清石灰水 的质量 | |
反应前 | 13.6g | 102.5g |
反应后 | 11.2g | 108.0g |
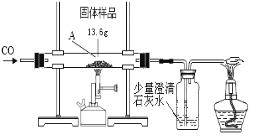
请计算:
⑴实验中先通CO的目的是____________________________________。
⑵从上表中选择合适的数据,计算固体样品中氧化铁的质量是_____________克。
⑶在上述反应后的固体中加入100g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数___。(请写出完整计算过程,结果精确到0.1%)