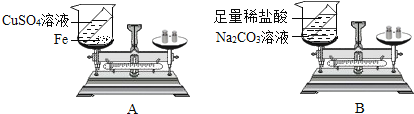
题目内容
【题目】用木炭还原氧化铜的实验如下图。
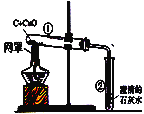
(1)酒精灯加灯罩的目的___________;
(2)刚开始预热,试管②中立即产生气泡,但石灰水不变浑浊,原因是_________;
(3)继续加热,观察到石灰水逐渐变浑浊,黑色粉末中出现红色物质。请你写出②中反应的化学方程式:_____________、
(4)停止加热时,应先将导管从试管②中撤出,并用弹簧夹夹紧橡皮管,待试管①冷却后再把试管里的粉末倒出。这样操作的原因是____________。
(5)木炭与氧化铜反应时的理论质量比为3:40,但在实际实验过程中所加入的木炭与氧化铜的质量比要_______(填“偏大”、“偏小”、“不变”)一些,原因是:__________。
(6)完全还原40克氧化铜,可生成铜多少克_______?(写出计算过程)
【答案】集中火焰,提高温度 开始导出的是试管中的空气 C+2CuO![]() 2Cu+CO2↑ 防止石灰水倒流,使热的试管破裂。 偏大 有部分木炭与试管内空气中的氧气反应 32g
2Cu+CO2↑ 防止石灰水倒流,使热的试管破裂。 偏大 有部分木炭与试管内空气中的氧气反应 32g
【解析】
(1)酒精灯加灯罩的目的减少火焰的摆动,集中火焰,提高温度。
(2)试管和导气管中有空气,开始导出的是试管中的空气。
(3)石灰水逐渐变浑浊,黑色粉末中出现红色物质,说明生成了二氧化碳和铜,即木炭与氧化铜在高温条件下反应生成二氧化碳和铜。
(4)停止加热时,试管①中温度降低,如果不先将导管从试管②中撤出,石灰水会倒流到试管①中,使热的试管破裂。用弹簧夹夹紧橡皮管,是防止空气进入将灼热的铜氧化为氧化铜。
(5)有部分木炭与试管内空气中的氧气反应,所以在实际实验过程中所加入的木炭与氧化铜的质量比要偏大一些。
(6)设完全还原40克氧化铜,可生成铜的质量是x。
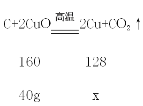
![]()
![]() =
=![]() ,解得x=32g
,解得x=32g

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目