题目内容
某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.请计算:(1)若要清洗100kg的这种石油产品,需要多少千克的NaOH?
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?
NaOH和Ca(OH)2的市场价格如下表:
| 名 称 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 6.00 | 24.00 |
分析:(1)根据反应的化学方程式确定反应中硫酸与氢氧化钠的质量关系,从而由残液中所含硫酸的质量求出需要氢氧化钠的质量;
(2)计算处理相同的残液需要两种碱的质量,并利用市场价格求出所花费的费用,对比两费用得出可以节约的经费;
(3)由于石油不溶于水,因此静置残液会出现分层,通过分液的方法对其中的石油进行分离.
(2)计算处理相同的残液需要两种碱的质量,并利用市场价格求出所花费的费用,对比两费用得出可以节约的经费;
(3)由于石油不溶于水,因此静置残液会出现分层,通过分液的方法对其中的石油进行分离.
解答:解:(1)设需要NaOH 的质量为x
H2SO4 +2NaOH═Na2SO4+2H2O
98 80
100kg×4.9% x
=
x=4 kg
答:需要4kg氢氧化钠.
(2)设需要Ca(OH)2的质量为y
H2SO4 +Ca(OH)2═Ca SO4+2H2O
98 74
100kg×4.9% y
=
y=3.7 kg
可以节约的经费为:24×4-6×3.7=73.8(元)
答:可以节约经费73.8元.
(3)石油不能溶解在水中,因此混合液体静置会出现分层,通过分液的方法即可分离出石油;
故答案为:清洗残液是水溶液,石油产品与不溶于水溶液,明显分层,可用分液的方式将它们分离.
H2SO4 +2NaOH═Na2SO4+2H2O
98 80
100kg×4.9% x
| 98 |
| 80 |
| 100kg×4.9% |
| x |
x=4 kg
答:需要4kg氢氧化钠.
(2)设需要Ca(OH)2的质量为y
H2SO4 +Ca(OH)2═Ca SO4+2H2O
98 74
100kg×4.9% y
| 98 |
| 74 |
| 100kg×4.9% |
| y |
y=3.7 kg
可以节约的经费为:24×4-6×3.7=73.8(元)
答:可以节约经费73.8元.
(3)石油不能溶解在水中,因此混合液体静置会出现分层,通过分液的方法即可分离出石油;
故答案为:清洗残液是水溶液,石油产品与不溶于水溶液,明显分层,可用分液的方式将它们分离.
点评:根据化学方程式可表示反应中各物质的质量比,利用反应中某一物质的质量可计算出反应中其它物质的质量.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.请计算:
(1)若要清洗100kg的这种石油产品,需要多少千克的NaOH?
(2)改石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?NaOH和Ca(OH)2的市场价格如下表:
(1)若要清洗100kg的这种石油产品,需要多少千克的NaOH?
(2)改石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?NaOH和Ca(OH)2的市场价格如下表:
| 名 称 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 6.00 | 24.00 |
(1)酸、碱、盐溶解性表是学习化学的重要工具.右表列出了“部分酸、碱、盐在20℃时的溶解性”.请按下列要求填写有关内容:
判断:NaNO3与BaCl2溶液能否发生反应?
填“是”或“否”);理由是 ;
写出铁或铝与表中的一种盐反应的化学方程式:
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.
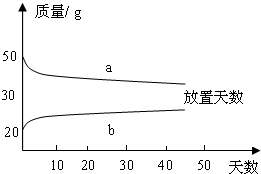
a、b曲线中表示浓硫酸的是(填字母序号) ;理由是 .
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH kg.
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| OH- | NO3- | Cl- | CO32- | SO42- | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
写出铁或铝与表中的一种盐反应的化学方程式:
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.

a、b曲线中表示浓硫酸的是(填字母序号)
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| 名称 | NaOH | Ca(OH)2 |
| 价格(元/kg) | 20.00 | 6.00 |
