题目内容
某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.请计算:(1)若要清洗100kg的这种石油产品,需要多少千克的NaOH?
(2)改石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?NaOH和Ca(OH)2的市场价格如下表:
| 名 称 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 6.00 | 24.00 |
分析:(1)根据硫酸与氢氧化钠反应的化学方程式,将100kg的这种石油产品中硫酸的质量代入化学方程式计算氢氧化钠的质量;
(2)根据硫酸与氢氧化钙反应的化学方程式来计算需要的氢氧化钙的质量,并利用它们的价格进行计算节约的经费.
(2)根据硫酸与氢氧化钙反应的化学方程式来计算需要的氢氧化钙的质量,并利用它们的价格进行计算节约的经费.
解答:解:(1)设需要NaOH的质量为x,则
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x 100kg×4.9%
=
,
解得x=
=4kg,
答:需要4千克的NaOH.
(2)设改进后需要Ca(OH)2的质量为y,则
Ca(OH)2+H2SO4=CaSO4+2H2O
74 98
y 100kg×4.9%
=
,
解得y=
=3.7kg,
则可以节约经费:4kg×24.00元/kg-3.7kg×6.00元/kg=73.8元
答:每处理100kg这种产品,可以节约73.8元.
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x 100kg×4.9%
| 80 |
| 98 |
| x |
| 100kg×4.9% |
解得x=
| 80×100kg×4.9% |
| 98 |
答:需要4千克的NaOH.
(2)设改进后需要Ca(OH)2的质量为y,则
Ca(OH)2+H2SO4=CaSO4+2H2O
74 98
y 100kg×4.9%
| 74 |
| 98 |
| y |
| 100kg×4.9% |
解得y=
| 74×100kg×4.9% |
| 98 |
则可以节约经费:4kg×24.00元/kg-3.7kg×6.00元/kg=73.8元
答:每处理100kg这种产品,可以节约73.8元.
点评:本题考查学生利用化学反应方程式的计算,学生应能利用质量和质量分数来计算硫酸的质量,然后代入方程式计算即可,本题较好的注重了与生活、生产的联系,体现了利用化学知识来解决生产中的实际问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
(1)酸、碱、盐溶解性表是学习化学的重要工具.右表列出了“部分酸、碱、盐在20℃时的溶解性”.请按下列要求填写有关内容:
判断:NaNO3与BaCl2溶液能否发生反应?
填“是”或“否”);理由是 ;
写出铁或铝与表中的一种盐反应的化学方程式:
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.
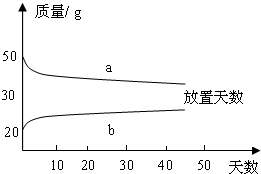
a、b曲线中表示浓硫酸的是(填字母序号) ;理由是 .
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH kg.
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| OH- | NO3- | Cl- | CO32- | SO42- | |
| H+ | 溶、挥 | 溶、挥 | 溶、挥 | 溶 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca+ | 微 | 溶 | 溶 | 不 | 微 |
| Ba2+ | 溶 | 溶 | 溶 | 不 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 不 | 溶 |
写出铁或铝与表中的一种盐反应的化学方程式:
(2)浓硫酸和稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.

a、b曲线中表示浓硫酸的是(填字母序号)
(3)①某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸.若要清洗100kg的这种石油产品,理论上需要NaOH
②石化厂进行了技术改造,改用Ca(OH)2中和这些残余硫酸.每处理100kg这种产品,可以节约多少经费?( NaOH和Ca(OH)2的市场价格如下表):
| 名称 | NaOH | Ca(OH)2 |
| 价格(元/kg) | 20.00 | 6.00 |
