题目内容
【题目】生活中常见物质的性质制法等是化学研究的重要内容。完成下列试题。
(1)铁是生活中应用最广泛的金属,铁粉可以做某些食品的防腐剂,该铁粉的作用是_____。这种防腐剂失效后(主要成分为氧化铁),可用于实验室模拟工业炼铁,写出该反应的化学方程式_____,
(2)氢氧化钠稀溶液与稀盐酸反应过程中温度和pH的变化如图所示
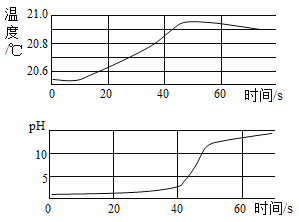
①该实验是将_____溶液中(填写滴加溶液的顺序)。
②该反应是_____反应(填“吸热”或“放热”)。
③40s时,溶液中溶质为_____
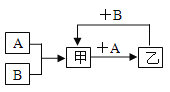
(3)除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:a加过量的NaOH溶液; b加过量的Na2CO3溶液; c.加适量的盐酸; d过滤; e加过量的BaCl2溶液。
[提示:Mg(OH)2、BaSO4、BaCO3难溶于水]
①以上操作合理的先后顺序为_____(数字序号不能重复使用)。
②加入适量稀盐酸的作用是_____,
(4)向碳酸钠和氯化钠的固体混合物15.9g中加入100g稀盐酸,恰好完全反应后,得到111.5g溶液。则原混合物中碳酸钠的质量分数是多少?_____(结果精确到0.1%)
【答案】吸收氧气和水蒸气 Fe2O3+3CO![]() 2Fe+3CO2 氢氧化钠稀溶液滴加到稀盐酸 放热 HCl和NaCl aebdc, 除去多余的氢氧化钠和碳酸钠,调整溶液的pH为7 66.7%
2Fe+3CO2 氢氧化钠稀溶液滴加到稀盐酸 放热 HCl和NaCl aebdc, 除去多余的氢氧化钠和碳酸钠,调整溶液的pH为7 66.7%
【解析】
铁生锈是铁与氧气和水反应,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀。
(1)铁生锈是铁与氧气和水反应,铁粉可以做某些食品的防腐剂,该铁粉的作用是吸收氧气和水蒸气。这种防腐剂失效后(主要成分为氧化铁),可用于实验室模拟工业炼铁,该反应的化学方程式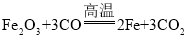 。
。
(2)①由溶液的pH由小于7逐渐增大到等于7、大于7,说明了该实验是将氢氧化钠稀溶液滴加到稀盐酸 溶液中。
②该反应过程中溶液温度升高,说明了该反应是放热反应。
③由图示可知,40s时,溶液中的稀盐酸未完全反应,溶液中溶质为HCl和NaCl。
(3)镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子调整溶液的pH,所以合理的先后顺序为aebdc。
(4)根据质量守恒定律可知,生成的二氧化碳的质量为![]()
设混合物中碳酸钠的质量为x
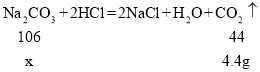
![]()
![]()
原混合物中碳酸钠的质量分数是为![]()
故原混合物中碳酸钠的质量分数是66.7%。