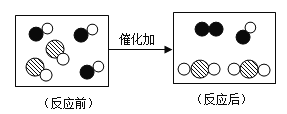
题目内容
【题目】某化学兴趣小组向一定量AgNO3、Cu(NO3)2、Al(NO3)3混合溶液中加入一定量的锌粉,充分反应后过滤,滤液呈蓝色。
(1)向滤渣上滴加稀盐酸,_____(填“有”或“没有”)气泡产生。
(2)滤液中一定含有的溶质是_____。
(3)写出一定发生的化学反应方程式_____。
【答案】没有 Zn(NO3)2、Cu(NO3)2、Al(NO3)3; Zn+2AgNO3=Zn(NO3)2+2Ag
【解析】
铝比锌活泼,锌比铜活泼,铜比银活泼,往含有AgNO3、Cu(NO3)2、Al(NO3)3的废液中加入一定量锌粉,锌不能和硝酸铝反应,先和硝酸银反应,如果锌过量,则再和硝酸铜反应。由充分反应后过滤,滤液呈蓝色,说明了锌没有剩余,溶液中含有硝酸铜。
(1)铝比锌活泼,锌比铜活泼,铜比银活泼,往含有AgNO3、Cu(NO3)2、Al(NO3)3的废液中加入一定量锌粉,锌不能和硝酸铝反应,先和硝酸银反应,如果锌过量,则再和硝酸铜反应。由充分反应后过滤,滤液呈蓝色,说明了锌没有剩余,向滤渣上滴加稀盐酸,没有气泡产生。
(2)铝比锌活泼,锌比铜活泼,铜比银活泼,往含有AgNO3、Cu(NO3)2、Al(NO3)3的废液中加入一定量锌粉,锌不能和硝酸铝反应,先和硝酸银反应,如果锌过量,则再和硝酸铜反应。由充分反应后过滤,滤液呈蓝色,说明了锌没有剩余,溶液中含有硝酸铜,滤液中一定含有的溶质是 Zn(NO3)2、Cu(NO3)2、Al(NO3)3。
(3)一定发生的反应是锌与硝酸银发生了反应,化学反应方程式是![]()

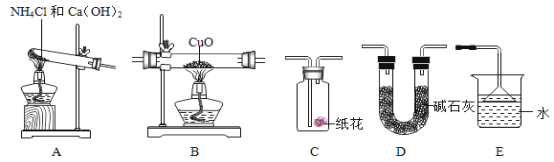
【题目】氢化钙(CaH2)固体是登山运动员常用的能源提供剂。某化学兴趣小组在实验室模拟制备氢化钙,并用制得的氢化钙进行实验探究。
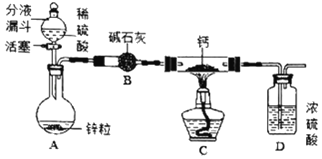
实验一:实验室模拟制备氢化钙
(查阅资料)①用H2与钙加热的方法可制得CaH2
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气
③碱石灰能吸收水蒸气
同学们设计了如图所示的实验装置。
(1)写出装置A中反应的化学方程式_____。
(2)装置D的作用是_____。
(3)制得的氢化钙要密封保存,其遇水反应生成一种碱和一种可燃性气体,写出该反应的化学方程式_____。
实验二:取少量上述制得的CaH2样品加入到一定量的碳酸钠溶液中,产生大量气泡,过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙,小组同学对滤液的溶质进行探究
(猜想假设)猜想一:NaOH 猜想二:NaOH、Ca(OH)2
猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,原因是_____。
(实验验证)
实验操作 | 实验现象 | 实验结论 |
1、取滤液,向其中滴入少量的Na2CO3溶液 | _____ | 猜想二不成立 |
2、另取滤液,向其中加入足量的稀盐酸 | _____ | 猜想三成立 |
(拓展延伸)
登山运动员用氢化钙作能源提供剂,与氢气相比,优点是_____。