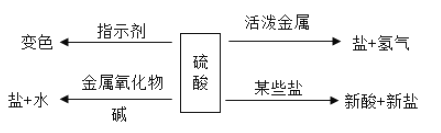
题目内容
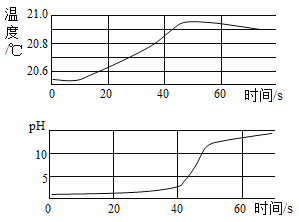
【题目】分别向50g FeSO4和CuSO4溶液中,加入一定质量Mg 粉恰好完全反应。随Mg粉消耗,Mg粉与溶液中FeSO4、CuSO4的质量变化见图。请读取图象信息并结合金属活动性顺序分析,下面说法不合理的是( )
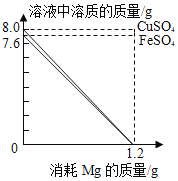
A.反应前,两溶液中溶剂水的质量相等
B.反应前,两溶液中溶质质量分数:FeSO4<CuSO4
C.反应后,两溶液底部析出金属的质量:Fe<Cu
D.反应后,若FeSO4和CuSO4对应新溶液的溶质质量分数分别为A、B,则A<B
【答案】A
【解析】
镁比铁活泼,铁比铜活泼,镁和硫酸亚铁反应生成硫酸镁和铁,和硫酸铜反应生成硫酸镁和铜。
A、反应前,FeSO4溶液中溶剂的质量为50g-7.6g=42.4g;CuSO4溶液中溶剂的质量为50g-8.0g=42g;可得两溶剂水的质量不相等,选项说法不合理;故符合题意;
B、反应前,硫酸铜质量是8g,硫酸亚铁质量是7.6g,溶液质量相等,因此溶液中溶质质量分数:FeSO4<CuSO4,选项说法合理;故不符合题意;
C、镁和硫酸亚铁、硫酸铜反应的化学方程式及其质量关系为:
![]()
![]()
由质量关系可知,镁质量相等时生成铁的质量小于生成铜的质量,结合图中数据可知,消耗镁的质量都是1.2g,因此反应后两溶液底部析出金属的质量:Fe<Cu,选项说法合理;故不符合题意;
D、反应后,生成铜质量大于生成铁的质量,因此硫酸亚铁和镁反应后形成的溶液质量大于硫酸铜和镁反应形成的溶液质量,若FeSO4和CuSO4对应新溶液的溶质质量分数分别为A、B,则A小于B,选项说法合理;故不符合题意;
故选A

【题目】生铁是铁和碳的合金.为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入65.0g稀硫酸,恰好完全反应(假设杂质不参与反应).测得的实验数据如下:
反应前 | 反应后 | |
烧杯及其中物质的质量 | 97.0g | 96.8g |
请你完成有关计算(结果保留一位小数):
(1)反应放出的氢气是多少?
(2)生铁样品中铁的质量分数是多少?
(3)反应后所得溶液的质量是多少?