题目内容
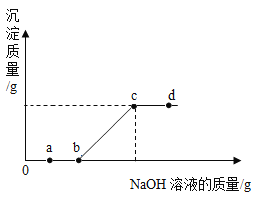
【题目】某班同学为检验氢氧化钠溶液是否变质,向盛有氢氧化钠溶液的试管中加入一定量的稀盐酸,迅速用带导气管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的 试管中观察到澄清石灰水变浑浊(如图所示)。请回答下列问题(提示:CaCl2溶液显中性):
(1)氢氧化钠溶液变质的化学反应化学方程式为_____。
(2)实验结束后,将两支试管中的所有物质倒入同一个废液缸中, 充分反应后得到澄清溶液。同学们对废液中溶质的成分进行如下探究(忽略二氧化碳的影响):
(提出问题)废液中溶质的成分是什么?
(做出猜想)
猜想一:CaCl2、NaCl和HCl
猜想二:CaCl2、NaCl和Na2CO3
猜想三:CaCl2、NaCl
小明对上述猜想二提出质疑,认为该猜想不成立。其原因是_____。
(设计实验)请完成实验报告
实验步骤 | 实验现象 | 实验结论 |
取少量废液于试管中,加入_____; | _____ | 猜想一成立 |
(反思拓展)最终同学们确认了废液中溶质的成分。若将废液直接排入铸铁管道引起的危害是_____,你认为该废液的处理方法是_____。
向含有氯化钠、氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液, 溶液的 pH变化情况如图所示:
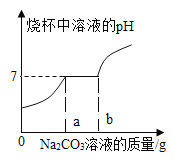
(1)0-a段发生的化学反应方程式为_____。
(2)a-b 段溶液的 pH 没有变化的原因是:_____。
【答案】![]() 因为充分反应后得到澄清溶液,而猜想二中氯化钙和碳酸钠会反应生成白色沉淀碳酸钙,所以猜想二不成立 锌粉(合理均可) 锌粉溶解,并有气泡产生 会腐蚀铸铁管道,污染地下水 加入过量的石灰石处理
因为充分反应后得到澄清溶液,而猜想二中氯化钙和碳酸钠会反应生成白色沉淀碳酸钙,所以猜想二不成立 锌粉(合理均可) 锌粉溶解,并有气泡产生 会腐蚀铸铁管道,污染地下水 加入过量的石灰石处理 ![]() a-b段发生的反应为
a-b段发生的反应为![]() ,对溶液的酸碱性没有影响。
,对溶液的酸碱性没有影响。
【解析】
向氢氧化钠溶液中加入稀盐酸产生气体,并且产生的气体能使澄清石灰水变浑浊,说明产生的气体为二氧化碳,所以氢氧化钠溶液已经变质生成碳酸钠;
将反应后的溶液混合得到澄清的溶液,而猜想中二氯化钙和碳酸钠会反应生成白色沉淀碳酸钙,所以猜想二不成立;猜想一和猜想三唯一的区别就是前者有HCl,后者没有,所以要验证哪个猜想正确,就是验证是否存在HCl。向溶液中加入锌粉,若锌粉溶解,并产生气泡,则证明含有HCl,猜想一成立。
含有HCl的废液不能直接排入铸铁管道,会腐蚀管道,污染地下水,所以先要用石灰石处理。
向含有CaCl2、NaCl和HCl的溶液中加入碳酸钠溶液,碳酸钠先和盐酸反应生成氯化钠、二氧化碳和水,使溶液pH升高,接着和CaCl2反应生成碳酸钙和氯化钠,溶液的pH不变,再加碳酸钠,不再反应,因为碳酸钠溶液显碱性,所以溶液pH会增大。
(1)向氢氧化钠溶液中加入稀盐酸产生气体,并且产生的气体能使澄清石灰水变浑浊,说明产生的气体为二氧化碳,所以氢氧化钠溶液已经变质生成碳酸钠,化学方程式为:![]() ;
;
做出猜想:
因为充分反应后得到澄清溶液,而猜想二中氯化钙和碳酸钠会反应生成白色沉淀碳酸钙,所以猜想二不成立;
设计实验:
因为猜想一成立,而猜想一和猜想三唯一的区别就是前者有HCl,后者没有,所以就是要验证存在HCl。向溶液中加入锌粉,若锌粉溶解,并产生气泡,则证明含有HCl;
反思拓展:
含有HCl的废液不能直接排入铸铁管道,会腐蚀管道,污染地下水,所以先要用石灰石处理。
(1)向含有CaCl2、NaCl和HCl的溶液中加入碳酸钠溶液,碳酸钠先和盐酸反应生成氯化钠、二氧化碳和水,使溶液pH升高,化学方程式为:![]()
(2)再加碳酸钠,会继续和氯化钙反应生成碳酸钙和氯化钠,反应物和生成物均对溶液的酸碱性无影响,故溶液的pH不变。

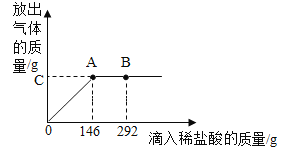
【题目】我市某地石灰石资源丰富,化学兴趣小组的同学为了测定该石灰石中碳酸钙的质量分数,用托盘天平称取了5份石灰石样品,分别加入各盛有200.0克稀盐酸的烧杯中充分反应(假设杂质不反应),得如下实验数据:
实验编号 | 1 | 2 | 3 | 4 | 5 |
石灰石样品的质量/g | 12.5 | 25.0 | 37.5 | 50.0 | 62.5 |
生成CO2的质量/g | 4.4 | 7.5 | 13.2 | 17.6 | 17.6 |
分析上述实验数据并回答:
(1)实验编号为_______的实验数据有明显错误。
(2)这种石灰石样品中碳酸钙的质量分数为__________。
(3)求稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)________。
【题目】下表是KNO3和Ca(OH)2在不同温度时的溶解度。下列说法错误的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
Ca(OH)2 | 0.19 | 0.17 | 0.16 | 0.14 | 0.13 | 0.11 | |
A.硝酸钾的溶解度随温度的升高而增大,氢氧化钙的溶解度随温度的升高而减小
B.硝酸钾中含有少量氢氧化钙时,可以用冷却热饱和溶液的方法提纯硝酸钾
C.氢氧化钙的不饱和溶液转化为饱和溶液可以采取升高温度的方法
D.20℃时,氢氧化钙饱和溶液的溶质质量分数为 0.17%