题目内容
【题目】向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( )
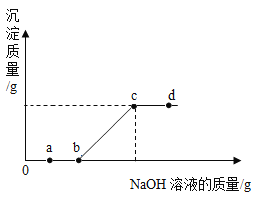
A.a 点溶液中含有两种溶质
B.bc 段发生了中和反应
C.c 点溶液中的溶质为 Na2SO4
D.d 点溶液呈中性
【答案】C
【解析】
向硫酸和硫酸铜的混合溶液中加入氢氧化钠溶液,氢氧化钠先和硫酸发生中和反应生成硫酸钠和水,待硫酸反应完后,氢氧化钠再和硫酸铜反应生成氢氧化铜沉淀和硫酸钠。
A、a点表示氢氧化钠与硫酸反应,且硫酸还没有反应完,所以溶液中含硫酸、硫酸钠和硫酸铜三种溶质,A不正确;
B、bc 段表示硫酸铜与氢氧化钠反应,沉淀质量不断增加,是盐与碱的反应,不属于中和反应,B不正确;
C、c 点表示硫酸铜与氢氧化钠刚好完全反应,溶液中的溶质只有 Na2SO4,C正确;
D、d 点溶液中氢氧化钠过量,溶液呈碱性,D不正确。故选C。

 名校课堂系列答案
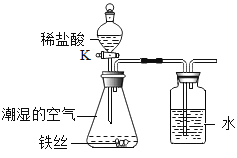
名校课堂系列答案【题目】某班同学为检验氢氧化钠溶液是否变质,向盛有氢氧化钠溶液的试管中加入一定量的稀盐酸,迅速用带导气管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的 试管中观察到澄清石灰水变浑浊(如图所示)。请回答下列问题(提示:CaCl2溶液显中性):
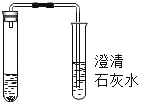
(1)氢氧化钠溶液变质的化学反应化学方程式为_____。
(2)实验结束后,将两支试管中的所有物质倒入同一个废液缸中, 充分反应后得到澄清溶液。同学们对废液中溶质的成分进行如下探究(忽略二氧化碳的影响):
(提出问题)废液中溶质的成分是什么?
(做出猜想)
猜想一:CaCl2、NaCl和HCl
猜想二:CaCl2、NaCl和Na2CO3
猜想三:CaCl2、NaCl
小明对上述猜想二提出质疑,认为该猜想不成立。其原因是_____。
(设计实验)请完成实验报告
实验步骤 | 实验现象 | 实验结论 |
取少量废液于试管中,加入_____; | _____ | 猜想一成立 |
(反思拓展)最终同学们确认了废液中溶质的成分。若将废液直接排入铸铁管道引起的危害是_____,你认为该废液的处理方法是_____。
向含有氯化钠、氯化钙和稀盐酸的混合溶液中滴加碳酸钠溶液, 溶液的 pH变化情况如图所示:
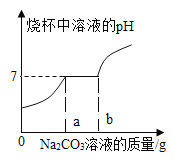
(1)0-a段发生的化学反应方程式为_____。
(2)a-b 段溶液的 pH 没有变化的原因是:_____。
【题目】由于二氧化碳与氢氧化钠溶液反应无明显现象,对此同学们展开了探究,
(提出问题)二氧化碳与氢氧化钠溶液能否发生反应?
(查阅资料)①已知碳酸氢钠溶液不与二氧化碳反应。
②常温下,氢氧化钠、碳酸钠在乙醇中的溶解性如下。
溶剂 | 乙醇 | |
溶质 | 氢氧化钠 | 碳酸钠 |
溶解性 | 易溶 | 难溶 |
(方案设计)小明同学设计了如图所示装置进行探究。
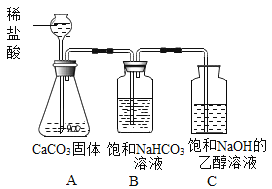
(实验探究)
(1)溶液配制。C中饱和溶液:将一定质量的氢氧化钠固体加入到一定体积的乙醇中,用玻璃棒不断搅拌,使其成为饱和氢氧化钠的乙醇溶液。玻璃棒的作用是____。判断C中饱和溶液形成的现象是____。
(2)进行实验,按图所示装置加入药品后进行实验。B装置的作用是____,C中观察到的现象是____。
(实验结论)
(3)由此小明得出二氧化碳与氢氧化钠发生了化学反应,反应的化学方程式为____。
(反思交流)
(4)小刚同学认为小明的实验还不足以证明二氧化碳与氢氧化钠发生了化学反应,还应补充的实验是____。