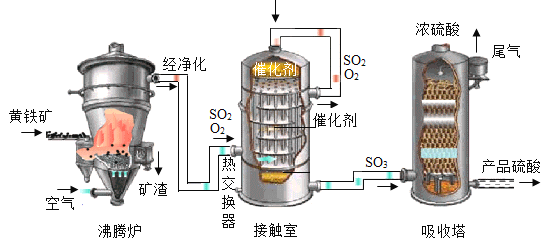
题目内容
【题目】下列图像能正确反映对应变化关系的是
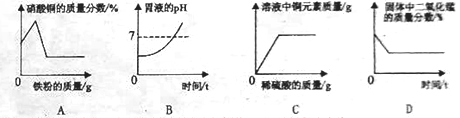
A. 在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量
B. 用胃舒平[主要成分Al(OH)3]治疗胃酸过多时胃液pH的情况
C. 向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量
D. 加热一定量氯酸钾和二氧化锰固体混合物
【答案】C
【解析】根据所学知识和题中信息知,A、在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量,铁比铜活泼,铜比银活泼,铁与硝酸银溶液反应生成硝酸亚铁和银,铁与硝酸铜溶液反应生成硝酸亚铁和铜,硝酸铜的质量分数最后应变为零,故A错误;B、用胃舒平[主要成分Al(OH)3]治疗胃酸过多时胃液pH的情况,氢氧化铝与盐酸反应生成氯化铝和水,氢氧化铝属于固体,pH值不可能超过7,故B错误;C、向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量,氧化铜与稀硫酸反应生成硫酸铜和水,溶液中铜元素的质量应先增加,后达一定值,故C正确;D、加热一定量氯酸钾和二氧化锰固体混合物,二氧化锰是氯酸钾分解的催化剂,氯酸钾分解为氯化钾和氧气,固体中二氧化锰的质量分数应先增加,后达一定值,故D错误。
点睛∶铁比铜活泼,铜比银活泼,铁与硝酸银溶液反应生成硝酸亚铁和银,铁与硝酸铜溶液反应生成硝酸亚铁和铜。二氧化锰是氯酸钾分解的催化剂。

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】实验小组将澄清石灰水和碳酸钠溶液混合,充分反应后过滤,得到了滤液M,同学们对滤液M中溶质的成分进行探究,探究过程如下:
[猜想与假设]①含有NaOH;
②含有____.
③含有NaOH、Na2CO3;
④含有 NaOH、Na2CO3和Ca(OH)2。
[设计与实验]
(1)大家认为猜想_____一定不正确,其原因是_______。
(2)甲同学取滤液M样品,向其中加入足量的____,不产生气泡,则猜想③不正确。
(3)乙同学依据甲同学的实验结论继续实验,记录如下
实验操作 | 现象 | 结论 |
取一定量滤液M于试管中,加入__溶液 | ________ | 猜想②成立 |
相关反应的化学方程式为____。
[交流与反思]若将滤液M直接倒入下水道,对环境造成的影响是会污染水源。
(4)若假设①成立,取反应后的滤液M 100克,加入10克溶质质量分数为3. 65%的稀盐酸恰好完全反应,则滤液中溶质的质量分数是多少____?
【题目】某化学兴趣小组同学学习了解碱盐的知识后,到实验室做碳酸钠与盐酸反应的实验。
小华实验:取![]() 溶液于试管中,再用胶头滴管滴入少量稀盐酸,无明显现象;
溶液于试管中,再用胶头滴管滴入少量稀盐酸,无明显现象;
小红实验:取2mL稀盐酸于试管中,再用胶头滴管滴入少量![]() 溶液,马上观察到有气泡产生。两人实验所用的
溶液,马上观察到有气泡产生。两人实验所用的![]() 溶液、稀盐酸均相同,却观察到不同的实验现象,他们为查明原因,进行了以下探究。
溶液、稀盐酸均相同,却观察到不同的实验现象,他们为查明原因,进行了以下探究。
(查阅资料)
①盐酸和![]() 溶液反应是分步进行的,即:反应1:
溶液反应是分步进行的,即:反应1:![]() 先
先![]() ;反应2:
;反应2:![]() 后
后![]()
②![]() 溶液与石灰水混合会变浑浊
溶液与石灰水混合会变浑浊
③![]() 可溶于水
可溶于水
(提出问题)小华实验没有观察到气体产生,是否只发生了“反应1”呢?
(思考分析)要证明只发生了“反应1”,需要证明![]() 的存在,若只发生了“反应1”,则小华实验后的溶液中除了有
的存在,若只发生了“反应1”,则小华实验后的溶液中除了有![]() 和NaCl,还可能有过量的
和NaCl,还可能有过量的![]() ,而
,而![]() 对
对![]() 的检验是有干扰的,设计实验时要考虑排除这个物质的干扰。
的检验是有干扰的,设计实验时要考虑排除这个物质的干扰。
(预计实验)
实验操作 | 现象预期 | 实验目的及反应方程式 |
步骤1:取少量小华实验后的溶液于试管中, ______ | 如果溶液中有 | 验证是否含有 |
步骤2 ______ | 如果小华实验后的溶液中有 | 证明 |
(交流反思)小红实验与小华实验有不同现象的原因是______。