��Ŀ����
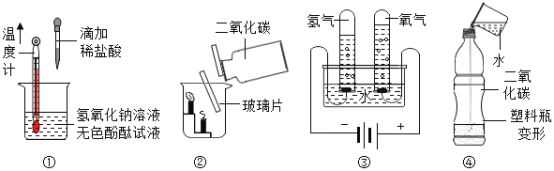
����Ŀ��2020�꣬����״������ȫ����Ű�����ø��˷����ǿ������¹����������Ч���������֡�84����Һ��ҽ�þƾ��ǾӼ����������ij�����Ʒ(��ͼ)��
(1)ҽ����ƿ��ֿ����赲70%��ϸ������������һ�������Ҫ������������Ҫ�Ǿ۱�ϩ���۱�ϩ����_____��
A ���� B ���� C ��Ȼ�߷��Ӳ��� D �ϳɸ߷��Ӳ���
(2)84����Һ�Ǵ�������(NaClO) Ϊ��Ҫ�ɷֵ�ˮ��Һ������������ˮ�пɲ��������ᣬ���������ǿ�����ԣ�����Чɱ��ϸ���Ͳ�����������������Ԫ�صĻ��ϼ�Ϊ_____��������Ļ�ѧʽΪ_____��84����Һ����������(��Ҫ�ɷ�Ϊ����)���ʹ�ã�ԭ���ǣ��������ƺ������Ϸ�Ӧ�������Ȼ��ơ�����(Cl2)��ˮ����������һ���ж����塣�÷�Ӧ�Ļ�ѧ����ʽΪ��_____��
(3)ҽ�þƾ���Ũ��Ϊ75%���Ҵ�(C2H5OH)��Һ������Чɱ���¹ڲ��������п�ȼ�ԡ�����˵����ȷ����_____(�����)��
A �Ҵ������л�������
B ҽ�þƾ���������ˮ���ܼ����Ҵ�
C ���Դ���Я��ҽ�þƾ���˹�������
D ʹ��ҽ�þƾ�����ʱ��Ӧ��Զ���Դ
(4)ѧУ����30kg������������Ϊ95%�ĸ�Ũ�Ⱦƾ���Ҫϡ�ͳ�75%��ҽ�þƾ�����Ҫ����ˮ_____kg��
���𰸡�D +1 HClO NaClO+2HCl=Cl2��+NaCl+H2O�� AD 8
��������
(1)�۱�ϩ��һ�ֺϳ���ά�����ںϳɸ߷��Ӳ��ϣ���ѡD��
(2)���������У���Ԫ����+1�ۡ���Ԫ���ԩ�2�ۣ�����Ԫ�صĻ��ϼ���x�������ڻ��������������ϼ۴�����Ϊ�㣬�ɵã�(+1)+x+(��2)��0����x��+1���ɴ������ƵĻ�ѧʽ��֪����������ԩ�1�ۣ���Ϊ��Ԫ����+1�ۣ����Դ�����Ļ�ѧʽΪHClO���������ƺ����ᷢ����ѧ��Ӧ�������Ȼ��ơ�ˮ���ж�������(Cl2)����Ӧ�Ļ�ѧ����ʽΪ��NaClO+2HCl��Cl2��+NaCl+H2O��
(3)A���Ҵ���һ�ֺ�̼Ԫ�صĻ���������л������ѡ��˵����ȷ��
B��ҽ�þƾ��Ǿƾ���ˮ��Һ�����������Ǿƾ����ܼ���ˮ��ѡ��˵������
C���ƾ����п�ȼ�ԣ�Ϊ��ֹ�������֣�����Я������ҽ�þƾ���˹���������ѡ��˵������
D���ƾ����п�ȼ�ԣ�Ϊ��ֹ�������֣�ʹ��ҽ�þƾ�����ʱ��Ӧ��Զ���Դ��ѡ��˵����ȷ��
��ѡAD��
(4)��Һ��ˮϡ�͵Ĺ����У����ʵ��������䣬����Ҫ��ˮ������Ϊm����30kg��95%��(30kg+m)��75%��m��8kg��

 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� Сѧ��ĩ���Ծ�ϵ�д�
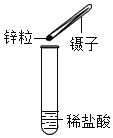
Сѧ��ĩ���Ծ�ϵ�д�����Ŀ��������ijУʵ���ҿ����գ�����ͬѧ��п��ϡ���ᷴӦ��ȡ�������������巢��װ���м���һ������п����Ȼ��60��ϡ��������μ��룬ÿ������������������±���
���� | ��һ�� | �ڶ��� | ������ |
����ϡ��������/g | 20 | 20 | 20 |
��������������/g | 0.08 | 0.08 | 0.04 |
�Լ��㣺
��1�����Ƶ�����_____g������_____gп����
��2��ʵ������ϡ���������ʵ�����������_____��д��������̣�
����Ŀ���ҹ�ij�����Ŷ������̿���Ҫ�ɷ���MnO2������SiO2��Fe2O3���������ʣ�Ϊ��Ҫԭ�ϣ���ȡ�ߴ�̼���̣�������������ͼ:
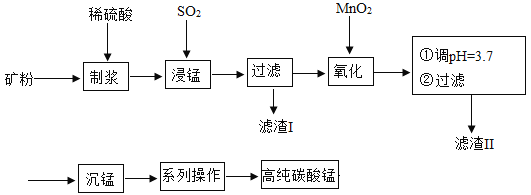
��֪����SiO2������ˮ������ϡH2SO4��SO2��Ӧ����MnO2�ܽ�Fe2+������Fe3+������Һ�е�Fe3+�� pH ���ڻ���� 3.2 ʱ����ȫת��ΪFe(OH)3������
��ش𣺣�1�������������ֱ�Ϊ_____��_____��д��ѧʽ�� ��
��2�����̹����з����� 2 ����ѧ��Ӧ������һ��ΪFe2O3��SO2��Ӧ���÷�Ӧ�Ļ�ѧ�� ��ʽΪFe2O3+ SO2+H2SO4=2FeSO4+ H2O����һ��ΪMnO2��SO2����ѧ������Ϊ 1��1 �������Ϸ�Ӧ����д���÷�Ӧ�Ļ�ѧ����ʽ��_____�� �÷�Ӧ�й���_____��Ԫ�صĻ��ϼ۷����˸ı䡣
��3����������������NH4HCO3��Һ�������� 4 �ֲ�����к���MnCO3������ij���� �壬д���÷�Ӧ�Ļ�ѧ����ʽ��_____��
��4��ȡ���õĸߴ�MnCO311.7g���������������У���������������������Ba(OH)2Ũ ��Һ���գ��õ���ɫ���� 19.7g�������ò�Ʒ�Ĵ���Ϊ_____��������һλС����
��5��ij�о�С����ϡH2SO4�����̿���MnCO3����Ӧ������Mn2+�����о�С��ѡ ������������Ϊ�о��������жԱ�ʵ�飬�������£�
����� | �¶�/������ | ������/��%�� | |
1 | 1��0.5 | 60 | 80.2 |
2 | 1��0.5 | 80 | 83.8 |
3 | 1��0.6 | 60 | X |
4 | 1��0.6 | 80 | 91.8 |
���� X ���п��ܵ���ֵΪ_____��
a��79.7 b��80.8 c��87.6 d��92.8
����Ŀ��С��ͬѧΪ�˲ⶨ����ʵ������ȡ������̼��ԭ��ʯ��ʯ(��Ҫ�ɷ���̼���)��̼��Ƶ�������������ȡ11.1 g�����ʯ��ʯ��ĩ��Ʒ�����Ĵθ��¼��ȡ���ȴ����������¼��������(���ʲ���Ӧ)��
�������� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
ʣ�����/g | 8.5 | 7.9 | 6.7 | 6.7 |
��֪̼��Ƹ����·ֽ����������ƺͶ�����̼���ʣ�
��1������________�η�Ӧʱ��̼�����ȫ��Ӧ��
��2����Ʒ��ȫ��Ӧʱ���ɶ�����̼_____ g��
��3����Ʒ��̼��Ƶ����������Ƕ��٣�����������ȷ��0.1%��
����Ŀ��KNO3 �� KCl �ڲ�ͬ�¶�ʱ���ܽ�������ʾ����ش��������⣺
�¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 |
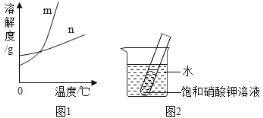
��1�������ϱ����ݣ����� KNO3 �� KCl ���ܽ�����ߣ���ͼ 1 ���ܱ�ʾ KNO3 �ܽ�����ߵ���_____���� m �� n����
��2��20 ��ʱ���� 10 g ˮ�м��� 2.5 g KNO3 ��ֽ���õ� X���ټ��� 2.5 g KNO3 ��ֽ���õ� Y������������ 50 ��õ� Z���� X��Y��Z ��Ϊ������Һ����_____��
��3��40 ��ʱ��100 g ˮ�е�����ر�����Һϡ�ͳ�������������Ϊ10%����Һ��Ӧ��ˮ������Ϊ_____��
��4����ͼ 2 ��ʾ��20 ��ʱ����ʢ�б��� KNO3 ��Һ��С�Թܷ���ʢˮ���ձ��У���ˮ�м���ij���ʺ��Թ����о�����������������ʿ����������е�_____������ĸ��ţ���
A. ����粒��� B. ��ʯ�ҹ��� C. ����
��5����40��ʱ����غ��Ȼ��صı�����Һ��������10
A. KNO3��Һ���������������KCl���������������
B. ��20���30��֮��ijһ�¶ȣ�������Һ�������������
C. ������Һ���ܼ���������
D. ������������Һ���£�������Һ��������������壬��ˮ��Һ���Ϊ������