题目内容
【题目】今天是某校实验室开放日,晓明同学用锌和稀硫酸反应制取氢气。先向气体发生装置中加入一定量的锌粒,然后将60克稀硫酸分三次加入,每次生成气体的质量如下表:
次数 | 第一次 | 第二次 | 第三次 |
加入稀硫酸质量/g | 20 | 20 | 20 |
生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
试计算:
(1)共制得氢气_____g和共加入_____g锌粒。
(2)实验所用稀硫酸中溶质的质量分数。_____(写出计算过程)
【答案】0.2g 6.5g 19.6%
【解析】
(1)根据前两次都是生成0.08g氢气,而第三次只生成0.04g氢气,说明金属已经完全反应,生成氢气的总质量为0.08g+0.08g+0.04g=0.2g
设:锌的质量为x。
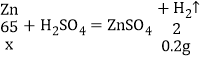
![]() x=6.5g
x=6.5g
(2)设:稀硫酸中溶质的质量分数为y。
根据题意可知,20g稀硫酸对应0.08g氢气生成;
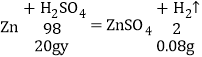
![]() x=19.6%。
x=19.6%。
答:(1)共制得氢气0.2g和共加入6.5g锌粒;
(2)实验所用稀硫酸中溶质的质量分数19.6%。

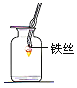
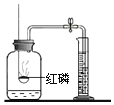
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
实 验 装 置 |
铁丝在氧气中燃烧 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
排水法收集氧气 |
解释 | 集气瓶中的水: 冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水: 吸收二氧化硫,防止污染空气 | 量筒中的水: 降温,吸收白烟 | 集气瓶中的水:水先将集气瓶内的空气排净后,便于观察O2何时收集满 |
A | B | C | D |
A. AB. BC. CD. D
【题目】某化工厂用废硫酸制备K2SO4的流程如下:
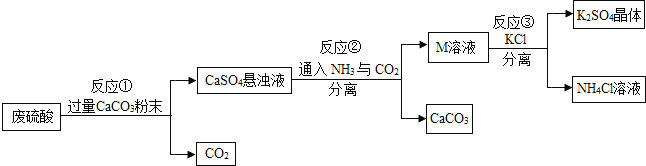
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(1)生产上将CaCO3研成粉末的目的是______。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是______(填化学式)。
(3)写出反应①的化学方程式:______。写出反应②的化学方程式:______。
(4)反应③中相关物质的溶解度如表所示。反应③在常温下能实现的原因是______。
(5)洗涤反应③所得晶体不用水而用饱和K2SO4溶液的目的是______。