题目内容
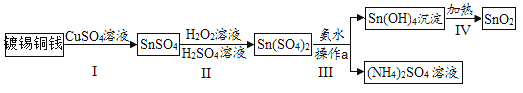
【题目】我国某科研团队以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料,制取高纯碳酸锰,工艺流程如下图:
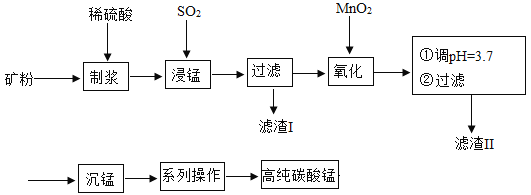
已知:①SiO2不溶于水,不与稀H2SO4、SO2反应;②MnO2能将Fe2+氧化成Fe3+;③溶液中的Fe3+在 pH 大于或等于 3.2 时将完全转化为Fe(OH)3沉淀。
请回答:(1)滤渣Ⅰ、Ⅱ分别为_____、_____(写化学式) ;
(2)浸锰过程中发生了 2 个化学反应,其中一个为Fe2O3与SO2反应,该反应的化学方 程式为Fe2O3+ SO2+H2SO4=2FeSO4+ H2O,另一个为MnO2和SO2按化学计量数为 1:1 发生化合反应,请写出该反应的化学方程式:_____, 该反应中共有_____种元素的化合价发生了改变。
(3)“沉锰”:加入NH4HCO3溶液后,生成了 4 种产物,其中含有MnCO3沉淀和某种气 体,写出该反应的化学方程式:_____。
(4)取所得的高纯MnCO311.7g溶于足量的盐酸中,将产生的气体用足量的Ba(OH)2浓 溶液吸收,得到白色沉淀 19.7g,则所得产品的纯度为_____%(保留一位小数)
(5)某研究小组用稀H2SO4与菱锰矿(含有MnCO3)反应来浸出Mn2+,该研究小组选 定两个因素作为研究条件进行对比实验,数据如下:
矿酸比 | 温度/(℃) | 浸出率/(%) | |
1 | 1:0.5 | 60 | 80.2 |
2 | 1:0.5 | 80 | 83.8 |
3 | 1:0.6 | 60 | X |
4 | 1:0.6 | 80 | 91.8 |
表中 X 最有可能的数值为_____。
a.79.7 b.80.8 c.87.6 d.92.8
【答案】SiO2 Fe(OH)3 MnO2+SO2=MnSO4 2 MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O; 98.3 c
【解析】
(1)SiO2不溶于水,不与稀H2SO4、SO2反应,滤渣Ⅰ为二氧化硅,氧化铁和硫酸反应生成硫酸铁和水,溶液中的Fe3+在 pH 大于或等于 3.2 时将完全转化为Fe(OH)3沉淀,滤渣Ⅱ为氢氧化铁,故填:SiO2;Fe(OH)3。
(2)MnO2和SO2按化学计量数为 1:1 发生化合反应,故化学方程式为MnO2+SO2=MnSO4,反应前锰元素+4价,硫元素+4价,反应后锰元素+2价,硫元素+6价,反应中共有两种元素化合价发生变化,故填:MnO2+SO2=MnSO4;2。
(3)“沉锰”:加入NH4HCO3溶液后,生成了 4 种产物,碳酸锰、硫酸铵、二氧化碳、水,故化学方程式为MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O,故填:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。
(4)解:设碳酸锰生成二氧化碳质量为x设碳酸锰质量为y。
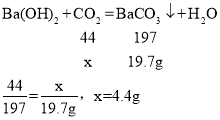
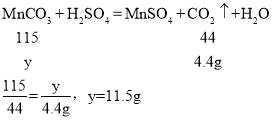
则所得产品的纯度为:
![]()
故填:98.3。
(5)从图表中可知,浸出率受矿酸比影响较大,受温度影响较小,故表中X应该要明显大于80.2而小于91.8,故X最可能的数值是87.6;故选:c。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案