题目内容
【题目】人类文明的发展和社会的进步同金属材料关系十分密切。
(一)铁的应用及防护
(1)生活中常用铁锅烹饪,主要利用铁的_____(填字母)。
a 导电性 b 导热性 c 耐腐蚀
(2)“发蓝“处理是在铁表面形成致密氧化膜,以防止其腐蚀。“发蓝”的原理是:36Fe + 4NaNO2 + 9NaNO3 + 26H2O=12X + 13NaOH + 13NH3↑,X的化学式为_____
(3)患贫血症的人体内需要补铁 ____(填字母)。
a 分子 b 原子 c 元素
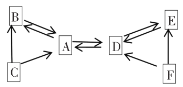
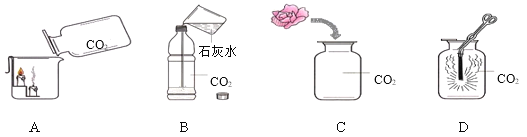
(4)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是____(选填序号)。

(5)铁生锈的主要过程为:
![]()
写出Fe(OH)2→Fe(OH)3反应的化学方程式______。
(二)铁的冶炼和探究
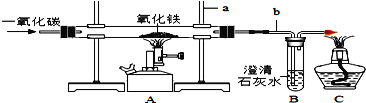
取20.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
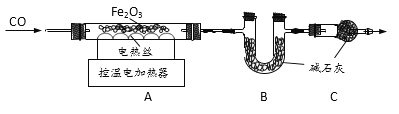
资料:碱石灰可吸收H2O和CO2。
(1)连接装置,先____,再装入药品。
(2)实验时先通入CO,目的是___。
(3)该实验装置有一个明显缺陷,你认为是___。
(4)控制A中温度在700℃至固体全部变黑,继续通CO至冷却。
①通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是____。
②现直接测得装置A中剩余固体质量为17.2g。则装置B中固体应增重___g。
(5)经分析A中剩余固体17.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4,充分反应,得H2 质量为0.1g。(FexOy和稀H2SO4反应,但无气体产生)
①固体中Fe质量为______g。 ②FexOy的化学式为____。
(三)成分探究
(查阅资料)用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO![]() 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO ![]() Fe+CO2
Fe+CO2
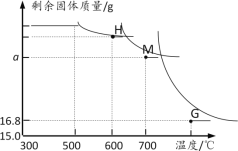
另取一定量Fe2O3进行上述实验,加热时固体质量随温度变化的曲线如图所示.回答下列问题:
(1)温度控制在300℃—500℃范围时,固体质量没有发生变化,原因是____。
(2)图中H点对应的固体成分的化学式是____
(3)图中M点对应a的数值=___
【答案】b Fe3O4 c c 4Fe(OH)2 +O2 +2H2O=4Fe(OH)3 检查装置的气密性 排空气防爆炸 无尾气处理 防止空气中的水和二氧化碳进入B中 7.7 2.8 FeO 没有达到反应温度 Fe3O4 18
【解析】
(一) (1)生活中常用铁锅烹饪,主要利用铁的导热性,选b;
(2)据质量守恒定律可知反应前后原子的种类个数不变,“发蓝”的原理是:36Fe + 4NaNO2 + 9NaNO3 + 26H2O=12X + 13NaOH + 13NH3↑,X的化学式为Fe3O4;
(3)元素是具有相同质子数的同一类原子的总称,患贫血症的人体内需要补铁元素 ,
(4)铁生锈是铁、氧气、水三种物质共同作用的结果,盐溶液的存在会加速锈蚀,最先观察到铁锈的是部分浸泡在氯化钠溶液中的铁钉,故选C;
(5)由图中信息可知, Fe(OH)2→Fe(OH)3的过程是氢氧化亚铁和氧气、水反应生成氢氧化铁,反应的化学方程式为:4Fe(OH)2 +O2 +2H2O=4Fe(OH)3 ;
(二)
(1)涉及气体的反应都有在气密性良好的装置内进行,连接装置,先检查装置的气密性,再装入药品。
(2)加热或点燃可燃性气体与空气的混合物易发生爆炸,实验时先通入CO,目的是排尽装置内的空气,防止加热时发生爆炸;
(3)实验产生的尾气中除反应生成的二氧化碳外,还有一定量剩余的一氧化碳,该实验装置有一个明显缺陷,是无尾气处理,会污染空气;
(4)控制A中温度在700℃至固体全部变黑,继续通CO至冷却。
①通过测定装置B中固体的质量变化,可知反应生成二氧化碳的质量,然后由铁和二氧化碳的质量关系,可准确求得装置A中剩余固体质量。装置C的作用是防止U型管内的碱石灰吸收空气中的二氧化碳和水蒸气;
②Fe2O3+3CO ![]() 2Fe+3CO2,由方程式可知装置A中固体减少的质量为参加反应的氧化铁中氧元素的质量,A中开始质量为20g,后测得质量为17.2g。减少2.8g,则装置B中固体应增重质量为x:
2Fe+3CO2,由方程式可知装置A中固体减少的质量为参加反应的氧化铁中氧元素的质量,A中开始质量为20g,后测得质量为17.2g。减少2.8g,则装置B中固体应增重质量为x:
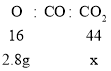
![]() x=7.7g
x=7.7g
(5)经分析A中剩余固体17.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4,充分反应,得H2 质量为0.1g。(FexOy和稀H2SO4反应,但无气体产生)
①设固体中Fe质量为y

![]() y=2.8g
y=2.8g
②20.0g Fe2O3中铁元素的 质量为20.0g ×![]() =14g,氧元素的质量为20.0g-1g=6g,FexOy中铁元素的质量为11.2g,氧元素:3.2g,质量比为56:16,化学式为FeO;
=14g,氧元素的质量为20.0g-1g=6g,FexOy中铁元素的质量为11.2g,氧元素:3.2g,质量比为56:16,化学式为FeO;
(三)成分探究
(1)由资料可知,反应需要在500℃以上开始进行,温度控制在300℃—500℃范围时,固体质量没有发生变化,原因是没有达到反应温度;
(2)图中H点对应的固体成分是四氧化三铁,化学式是Fe3O4;
(3)图中M点对应固体为FeO ,由3Fe2O3+CO![]() 2Fe3O4+CO2、Fe3O4+CO
2Fe3O4+CO2、Fe3O4+CO![]() 3FeO+CO2,可得关系式:3Fe2O3~2Fe3O4~6FeO,即Fe2O3~2FeO,
3FeO+CO2,可得关系式:3Fe2O3~2Fe3O4~6FeO,即Fe2O3~2FeO,
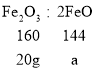
![]()
a的数值=18g

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】在浓硫酸的催化作用下,固体草酸(H2C2O4)受热分解生成碳的氧化物和水.某化学课外兴趣小组对碳的氧化物的成分进行了实验探究.
(提出问题)如何通过实验确定碳的氧化物的成分.
(猜想)
猜想1 | 猜想2 | 猜想3 |
只有CO | 只有CO2 | ______ |
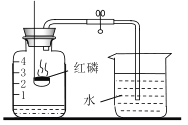
(设计实验)基于猜想3,兴趣小组同学设计了如图实验装置:
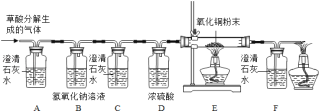
(实验探究)
(1)实验过程中观察到A装置中的澄清石灰水变浑浊,证明草酸分解时有CO2气体产生,A中发生的化学方程式为_______已知:氢氧化钠和氢氧化钙具有相似的化学性质。写出B中发生的化学方程式为______
(2)实验过程中还观察到以下实验现象:①C装置中澄清石灰水不变浑浊;②E装置中_____;③F装置中澄清石灰水变浑浊,证明有CO气体.
(实验结论)通过实验探究证明:猜想3成立.草酸分解的化学方程式是_______.
(问题讨论)
(1)C装置的作用是_______
(2)装置末端酒精灯的作用是尾气处理,写出发生反应的化学方程式_____。
(计算)某研究性学习小组的同学前往当地的石灰石矿区进行调查,他们取了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(杂质不溶于水,不与盐酸反应).
序号 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸质量g | 10 | 10 | 10 | 10 |
剩余固体质量g | 5.5 | 3.0 | 1.2 | m |
请计算:
(1)哪几次反应中碳酸钙有剩余________;
(2)上表中的m的数值应为________;
(3)这种石灰石中碳酸钙的质量分数为多少?(写出计算过程)______