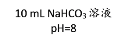题目内容
【题目】兴趣小组同学尝试用红心火龙果汁、发酵粉和面粉制作“紫红色花卷”。蒸熟后,却发现花卷变成了黄色。他们对此进行了探究。

(查阅资料)
①红心火龙果汁含天然色素,呈紫红色,受热易分解。②发酵粉主要成分是碳酸氢钠,受热分解生成碳酸钠、水和二氧化碳
(猜想与假设)
Ⅰ.紫红色花卷变黄与温度升高有关
Ⅱ.紫红色花卷变黄与发酵粉有关
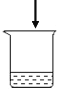
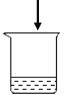
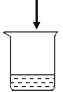
实验1:探究影响紫红色花卷变黄的因素。
序号 | 1-1 | 1-2 | 1-3 | 1-4 |
用品 | 红心火龙果汁、 面粉 | 红心火龙果汁、 面粉 | 红心火龙果汁、 面粉、发酵粉 | 红心火龙果汁、 面粉、发酵粉 |
操作 | 加热 | 不加热 | 加热 | 不加热 |
现象 | 从紫红变红棕色 | 仍为紫红色 | 从紫红变黄色 | 仍为紫红色 |
(1)碳酸氢钠的俗称是__________。
(2)实验1-1出现“从紫红色变红棕色”的原因是________。
(3)综合实验1,能得出的结论是__________。
实验2:继续探究实验1-3中花卷变黄的原因。
序号 | 2-1 | 2-2 | 2-3 |
实验过程 |
红心火龙果汁 |
红心火龙果汁 |
红心火龙果汁 |
现象 | 颜色无明显变化 | 一段时间后变黄色 | 较短时间后变黄色 |
(4)写出碳酸氢钠受热分解的化学方程式:_________。
(5)综合实验2,能得出的结论是_________。
(6)下列关于制作紫红色花卷的说法中,正确的是__________(填字母序号)。
A 当使用火龙果汁染色时,通过控制发酵粉的用量可以蒸出紫红色花卷
B 换用受热不易分解的紫红色果汁或紫薯汁,有可能蒸出紫红色花卷
C 酸碱性可能会影响蒸出花卷的颜色
【答案】小苏打 加热(使色素分解) 紫红色花卷变黄与温度升高和发酵粉都有关 ![]() 碳酸氢钠分解为碳酸钠,pH升高使火龙果汁更易变黄 BC
碳酸氢钠分解为碳酸钠,pH升高使火龙果汁更易变黄 BC
【解析】
(1)碳酸氢钠俗称小苏打,故答案为:小苏打;
(2)由资料可知红心火龙果汁受热易分解,故实验1-1出现“从紫红色变红棕色”的现象,故答案为:加热;
(3)由1-1和1-2可知,红心火龙果汁变色需要加热;由1-1和1-3可知红心火龙果汁由紫色变成黄色与发酵粉有关系;所以综合实验1,能得出的结论是:紫红色花卷变黄与温度升高和发酵粉都有关;
(4)碳酸氢钠受热分解为碳酸钠和水和二氧化碳,反应方程式为:![]() ;
;
(5)综合实验2可知,碳酸氢钠分解为碳酸钠,pH升高使火龙果汁更易变黄;
(6)A、红心火龙果汁与面粉和发酵粉加热就会由紫色变成黄色,所以通过控制发酵粉用量不可以蒸出紫红色花卷,选项错误;
B、换用受热不易分解的紫红色果汁或紫薯汁,如果紫红色果汁或紫薯汁与发酵粉加热不会变色,就有可能蒸出紫红色花卷,选项正确;
C、由实验二可知酸碱性可能会影响蒸出花卷的颜色,选项正确;
故选:BC。

【题目】小王同学在化工颜料店发现一种“银粉”,他猜想该“银粉”可能是银粉、铝粉或锌粉中的一种。为了确定“银粉”的成分,小王将一小包“银粉”带回实验室,并进行了如下实验和相关分析。
(1)取少量“银粉”于试管中,滴加适量盐酸,观察到_____,说明“银粉”一定不是银。
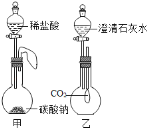
(2)为了进一步确定“银粉”是铝还是锌,小王通过理论计算,获得了铝与足量盐酸反应产生氢气的质量关系,并绘制了铝的图象(如图)。
Zn的质量/g | 0 | 3.25 | m | 9.75 | 13 | 16.25 |
H2的质量/g | 0 | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 |
①如表是锌与足量盐酸反应产生氢气的质量关系,请计算表中m的值(利用化学方程式进行计算,写出完整的计算过程)。_____。
②请你在该图中绘制出锌的图象。_____
(3)取1.8g“银粉”(杂质忽略不计)加入到50g稀盐酸中,恰好完全反应,生成氢气0.2g。根据如图可知,“银粉”是_____。
【题目】阅读下面科普短文。
青铜古称“吉金”,多为金黄色,主要是铜、锡、铅的合金。因其铜锈呈青绿色, 故名青铜。运用现代仪器分析青铜器及其锈蚀成分可以帮助我们对青铜器文物进行研究和保护。
研究人员利用X射线能谱仪对我国西周晚期某墓地出土的青铜容器、兵器、乐器的成分进行了分析,其中锡含量的分布频次如图。

研究人员利用X射线衍射分析技术对“镇国之宝”后母戊鼎西南足部位的锈蚀样品进行分析,结果如下:
| Cu2Cl(OH)3 | Cu2O | Cu2CO3(OH)2 | SnO2 | 其他 |
1 | 98% | 2% | 0 | 0 | 0 |
2 | 5% | 95% | 0 | 0 | 0 |
3 | 29% | 34% | 12% | 0 | 25% |
4 | 61% | 0 | 4% | 9% | 26% |
上述成分中,碱式氯化铜[Cu2Cl(OH)3]对青铜文物的危害极大,器物一旦沾染上这种物质,在环境湿度适宜的条件下,就会像患上瘟疫一样传染和蔓延,将会造成溃烂、穿孔,直至彻底瓦解。
依据文章内容回答下列问题。
(1)青铜名称的由来是_________。
(2)由锡含量的分布频次图推断,某件青铜兵器的锡含量可能是_______(填字母序号,下同)。
A 4% B 10% C 18% D 26%
(3)后母戊鼎西南足上的锈蚀成分中,属于氧化物的是__________。
A 氯化物 B 二氧化碳 C 水 D 氮气
(5)下列说法不合理的是__________。
A. 青铜器的锡含量可能与用途有关
B. 珍贵的青铜器应保存在绝氧、干燥的环境中
C. 保护青铜器时,无须关注环境中的氯化物
D. 后母戊鼎西南足的锈蚀样品中都含有Cu2Cl(OH)3和Cu2CO3(OH)2
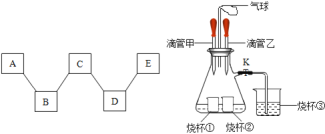
【题目】以下均为初中化学常见物质,由H、C、N、O、S、Na、Ca、Fe等元素中的一种或几种组成,化学小组做了如图实验,请回答:
(1)甲组同学实验中观察到溶液由无色变为浅绿色,则发生反应的方程式为_____;
(2)乙组同学通过实验发现五种物质之间的关系如图所示,“﹣﹣”两端的物质在一定条件下可以反应.若A~E分别属于单质、氧化物、酸、碱、盐中的四种类别,且有黑色固体、白色固体、黄色溶液、大量气泡等现象产生,则C的化学式为_____,D与E反应的化学方程式为_____,A与B反应的化学方程式为_____.
(3)丙组同学按图2进行实验,先关闭弹簧夹K,将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,打开弹簧夹K,烧杯③中液体倒流入锥形瓶中,且锥形瓶底部溶液由红色变为无色,无其它明显现象.请将下表中的试剂补充完整.
滴管甲 | 烧杯① | 滴管乙 | 烧杯② | 锥形瓶中溶液 | 烧杯③ | |
试剂 | H2O | _____ | _____ | _____ | _____ | _____ |