题目内容
【题目】A~G是初中常见的物质。其中E为黑色固体。如图为这些物质的转化关系图,其中部分生成物和反应条件已省略。
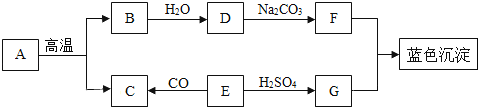
(1)写出下列物质的化学式:E._____,G._____。
(2)写出D→F的化学方程式:_____。
(3)可用Cu、O2和H2SO4作原料制得CuSO4,反应的化学方程式:_____。
【答案】CuO CuSO4 Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 2Cu+O2![]() 2CuO、CuO+H2SO4═CuSO4+H2O
2CuO、CuO+H2SO4═CuSO4+H2O
【解析】
E是黑色固体,能与硫酸反应,能与一氧化碳反应,氧化铜是黑色固体,氧化铜与硫酸反应生成硫酸铜和水,氧化铜能与一氧化碳反应生成铜和二氧化碳,故E可能是氧化铜,则与硫酸反应生成的G是硫酸铜,生成的C可能是二氧化碳;A高温分解生成的B能与水反应,碳酸钙高温分解生成氧化钙和水,氧化钙与水反应生成氢氧化钙,故B是氧化钙,A是碳酸钙;氧化钙与水反应生成的D是氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故F是氢氧化钠,氢氧化钠能与硫酸铜反应生成蓝色氢氧化铜沉淀,代入框图,推断合理。
根据以上分析可知:
(1)E物质为黑色的氧化铜,其化学式为CuO;G为硫酸铜,化学式为CuSO4;
(2)D→F即氢氧化钙与碳酸钠反应生成氢氧化钠和碳酸钙沉淀,反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)用Cu、O2和H2SO4作原料制得CuSO4,首先铜与氧气在加热条件下生成氧化铜,反应化学方程式为2Cu+O2![]() 2CuO;然后氧化铜再与硫酸反应生成硫酸铜和水,反应的化学方程式为CuO+H2SO4═CuSO4+H2O。
2CuO;然后氧化铜再与硫酸反应生成硫酸铜和水,反应的化学方程式为CuO+H2SO4═CuSO4+H2O。

【题目】某兴趣小组活动中,同学们按图1装置对“可燃物燃烧的条件”进行探究,探究过程中,大家对磷燃烧生成的大量白烟是否危害人体健康提出疑问。
(查阅资料)白磷的着火点是40℃,红磷的着火点是240℃,燃烧产物五氧化二磷是白色固体,会刺激人体呼吸道,并能与空气中的水蒸气反应,生成有毒的偏磷酸(H2PO3)。
(交流与讨论)白烟对人体健康有害,该实验装置必须改进。
(改进与实验)同学们按改进后的图2装置进行实验。

请你帮助他们将下表补充完整。
实验现象 | 对实验现象的解释 |
a试管中白磷燃烧,热 水中白磷没有燃烧 b试管中红磷没有燃烧 | (1)热水中白磷没有燃烧的原因是___________ (2)b试管中红磷没有燃烧的原因是________ |
(反思与评价)
(3)改进后的图2装置与图1装置比较的优点是___________。
(4)小雅同学指出图2装置仍有不足之处,并设计了图3装置,其中气球的作用是___________。
(5)检查完装置的气密性之后,小实进行了上述实验。实验小结时,小实同学认为还可以用冷却后的a试管测定空气中氧气的含量,他的操作是___________最终发现进入a试管内液体的体积小于试管容积的![]() ,如果不考虑橡皮塞占试管的容积,出现这种现象的原因可能是________。
,如果不考虑橡皮塞占试管的容积,出现这种现象的原因可能是________。
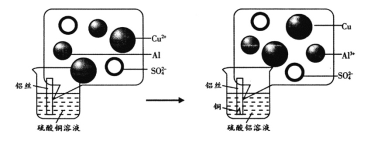
【题目】某学校化学兴趣小组的同学到化学实验室帮助老师准备酸、碱、盐性质的分组实验时,发现碱的药品柜中的一瓶氢氧化钠固体试剂瓶没有盖上瓶盖。小组同学征得老师的同意,决定对这瓶氢氧化钠固体进行探究。
(提出问题)这瓶氢氧化钠固体是否变质及变质的程度?
(查阅资料)
(1)氢氧化钠在空气中不仅吸收水分,还会与二氧化碳发生反应而变质,该反应的化学方程式为_____。
(2)BaCl2易溶于水,溶液呈中性;BaCO3是难溶于水的白色固体。
(猜想假设)
猜想一:没有变质
猜想二:部分变质
猜想三:_____
(设计实验方案)
为了提高同学们的动手操作能力和计算能力,老师要求同学们从定性和定量两方面来进行实验探究,下面是他们的探究方案,请你完成实验报告。
实验步骤 | 实验现象或结果 | 实验结论 |
①准确称量21.2g固体样品,平均分成两份,放到2个洁净的烧杯中加入适量水 | 全部溶解 | |
②向一烧杯中滴加足量的稀盐酸; | 有_____产生 | 猜想一不成立 |
③向另一烧杯中加入过量的BaCl2溶液,过滤、洗涤、干燥、称量。 | 得到19.7g白色沉淀 | 氢氧化钠固体已变质 |
(讨论交流)
(1)通过讨论同学们认为写出实验步骤③产生白色沉淀的化学反应是解答本题的关键,该反应的化学方程式为_____。
(2)通过利用以上数据计算,得出正确结论是猜想_____成立。
(3)同学们经过讨论认为在步骤③过滤后所得的滤液中,滴入酚酞溶液,溶液_____(填“不变色”或“变红色”),也能得出相同的结论。
(探究启示)我们做实验取完药品后,应_____。
【题目】小苏打(碳酸氢钠)在日常生活中有广泛的用途,工业上制取小苏打有多种方法,其中有一种是气相固碳法,其利用的原理是:![]()
资料:碳酸钠和碳酸氢钠的溶解度表(1个标准大气压下)(部分)
温度/℃ | 0 | 15 | 20 | 30 | 40 | 50 | 60 |
碳酸氢钠溶解度/g | 6.9 | 8.72 | 9.6 | 11.1 | 12.7 | 14.45 | 16.4 |
碳酸钠溶解度/g | 7.1 | 13.25 | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 |
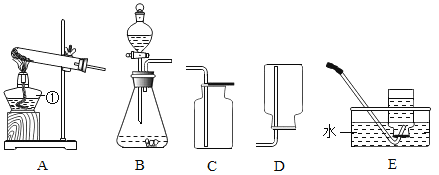
学校实验小组验证反应原理,在室温为15C时,同学们将10g氢氧化钠固体完全溶解溶于80g水中,而后缓慢且匀速地通入二氧化碳气体。同时用传感器测定溶液的pH变化,用数据采集器记录并绘制图象如图2所示。
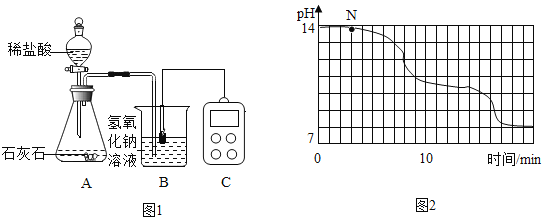
(1)图1中装置A的气密性检查方法是____________:该装置使用“分液漏斗”而不用“长颈漏斗”的原因是_____________
(2)通过图像分析,小苏打溶液显__________(填“酸性”、“中性”或“碱性”,图像中N点处发生的主要反应化学方程式为_____________。
(3)为了确定N处溶液的成分,同学们进行如下实验:
实验步骤 | 加入试剂 | 实验现象 | 初步实验结论 |
步骤一 | 滴入_______ | 溶液变红 | N处溶液的成分有____ |
步骤二 | 加入_______ | _______ |
(4)实验过程中,同学们发现18min后溶液的pH基本不再变化,则此时烧杯中可观察到的现象是______