题目内容
【题目】某校探究小组欲利用周末完成以下两项探究任务:
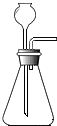
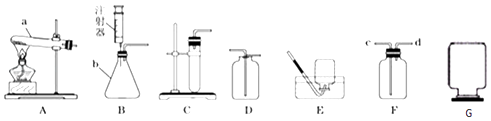
(1)任务一:选择下图所示仪器组装一套实验室制取纯净、干燥CO:的装置,并验证性质。
①所选仪器的连接顺序为(填写仪器序号字母)。
②若用F装置收集CO2 , 气体应从(填a或b)端管口进入。
③将CO2通入到D装置中,可观察到的现象是。
④将CO2通入到盛有蒸馏水的洗气瓶中,一段时间后测得洗气瓶中溶液的pH7(填“>”、“=”、“<”)。
⑤将CO2通人到NaOH溶液中可以制取Na2CO3 , 请写出化学方程式。
(2)任务二:探究过氧碳酸钠的化学组成
【查阅资料】将Na2CO3和H2O2混合,在一定条件制取过氧碳酸钠,用作漂白洗涤剂。过氧碳酸钠(相对分子质量为122)是一种白色固体粉末,易溶于水,能与水反应生成Na2CO3和一种单质。
为了探究过氧碳酸钠的化学组成,同学们设计了以下实验,请完成表格内容。
序号 | 实验步骤 | 实验现象 | 实验结论或解释 |
① | 向盛有过氧碳酸钠固体的试管中加入适量水 | 固体溶解 | 过氧碳酸钠溶于水,能与水反应。 |
② | 向序号①的所得溶液中加入适量的MnO2粉末 | 有大量气泡产生 | MnO2的作用是。 |
③ | 将带火星的木条置于试管口 | 木条复燃 | 过氧碳酸钠与水反应生成的单质是(填化学式)。 |
④ | 取序号③试管中的上层清液加入CaCl2溶液 | 产生白色沉淀 | 反应的化学方程式为。 |
实验小结 | 推算过氧碳酸钠的化学式是。 | ||
【答案】
(1)ACBE(或ACBF);b;澄清的石灰水变浑浊;<;CO2+2NaOH=Na2CO3+H2O
(2)催化作用;O2;Na2CO3+CaCl2=CaCO3 ↓+2NaCl;Na2CO4
【解析】(1)①制取二氧化碳用石灰石和稀盐酸,选的发生装置为A,除去氯化氢用饱和碳酸氢钠溶液,干燥用浓硫酸,收集可以用E或F,所以答案是ACBE(或ACBF);
②若用F装置收集CO2 , CO2的密度比空气大,CO2在下,空气在上应从a管出来,故气体CO2应从b端管口进入;
③将CO2通入到澄清石灰水中,CO2能与澄清反应生成碳酸钙沉淀,故看到的现象是澄清的石灰水变浑浊;
④将CO2通入到盛有蒸馏水的洗气瓶中,CO2与水反应生成碳酸,故一段时间后测得洗气瓶中溶液的pH<7;
⑤将CO2通人到NaOH溶液中生成Na2CO3 , 化学方程式为CO2+2NaOH=Na2CO3+H2O;(2)②MnO2的作用是催化作用;
③能使木条复燃的是O2;所以答案是O2;
④与CaCl2反应产生白色沉淀,反应化学方程式为Na2CO3+CaCl2=CaCO3 ↓+2NaCl; 根据现象推出过氧碳酸钠的化学式是Na2CO4。
【考点精析】关于本题考查的制取二氧化碳的操作步骤和注意点,需要了解1)原理:用石灰石和稀盐酸反应: CaCO3+2HCl==CaCl2+H2O+CO2↑2) 选用和制氢气相同的发生装置3)气体收集方法:向上排空气法4)验证方法:将制得的气体通入澄清的石灰水,如能浑浊,则是二氧化碳.验满方法:用点燃的木条,放在集气瓶口,木条熄灭.证明已集满二氧化碳气体才能得出正确答案.

【题目】生活离不化学,化学与生活息息相关.
(1)人体可以从水果和蔬菜中摄取 , 该类物质需要量很小,但可以起到调节新陈代谢、预防疾病和维持身体健康的作用.
营养成分表 | ||
营养成分 | 每片含量 | 每100g含量 |
镁 | 6.7mg | 1.12g |
叶酸 | 255 | 42.5mg |
(2)如表是某儿童补铁药品的部分说明.说明中的“铁”指的是(填“单质”、“元素”或“分子”).
(3)某些食品的近似pH如下:
食品 | 柠檬汁 | 苹果汁 | 葡萄汁 | 番茄汁 | 牛奶 | 玉米粥 |
pH | 2.4 | 3.1 | 4.2 | 4.4 | 6.5 | 7.8 |
其中酸性最强的是 , 胃酸过多的人应食用
(4)农业上用石灰乳和硫酸铜配制农药“波尔多液”时不宜用铁质容器,用化学方程式表示其原因 .
(5)如图为某化工企业生产流程示意图:下列说法正确的是 . (填选项序号) 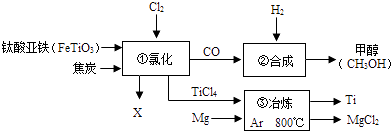
A.钛酸亚铁(FeTiO3)中钛元素为+3价
B.③中氩气(Ar)作反应物,反应类型为置换反应
C.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2
D.①中反应为:2FeTiO3+6C+7Cl2 ![]() 2X+2TiCl4+6CO,则X为FeCl3 .
2X+2TiCl4+6CO,则X为FeCl3 .
【题目】小明同学在家里的药箱中发现一瓶用来清洗伤口用的消毒液﹣﹣“双氧水”,他联想到在化学课上曾用过氧化氢溶液制取过氧气,他高兴的将家中的“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验. 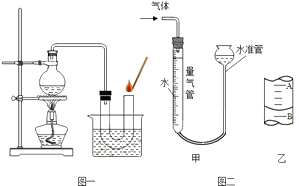
第一组实验:小明欲证明该双氧水是否失效.
(1)实验过程
①在试管中加入5mL“双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
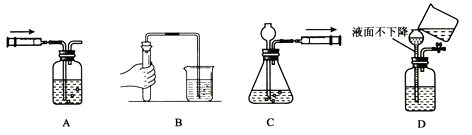
③按图一装置进行操作,带火星的木条复燃,水槽中冰水所起的作用是 .
(2)实验结论: .
第二组实验:小明欲探究Fe2O3能否作为H2O2分解的催化剂,并与MnO2的催化效果进行比较.小明、小李、小张三位同学同时进行H2O2的分解与气体的收集实验.实验时间均以30秒生成气体为准(H2O2均未全部分解)(见图二甲),其他可能影响实验的因素均忽略.相关数据如下:
同学序号 | 质量分数相同的H2O2溶液 | 溶液中加入的物质 | 收集到的气体体积 |
小明 | 100mL | 未加其他物质 | a ml |
小李 | 100mL | Fe2O3 0.5g | b ml |
小张 | 100mL | MnO2 0.5g | c ml |
若50mL量气管中液面的位置如图二乙所示,A与B刻度间相差1mL,刻度A为20,则此时气体的体积为mL.
(3)欲探究Fe2O3在实验中是否起催化作用,首先应比较和(选择a、b、c填空)的大小,
还需补充做如下实验(无需写出具体操作步骤):①;② .
实验结论:Fe2O3能加快H2O2的分解,起催化作用.
通过比较Fe2O3 和MnO2 在反应中的反应速率,发现Fe2O3 的催化效果没有二氧化锰好.