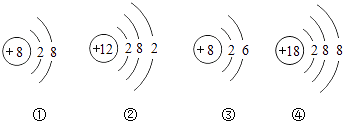
��Ŀ����
����Ŀ��С��ͬѧ�ڼ����ҩ���з���һƿ������ϴ�˿��õ�����Һ������˫��ˮ���������뵽�ڻ�ѧ�������ù���������Һ��ȡ�������������˵Ľ����еġ�˫��ˮ���õ�ѧУ��ʵ���ң�����ʦ��ָ���º�ͬѧ��һ����������ʵ�飮 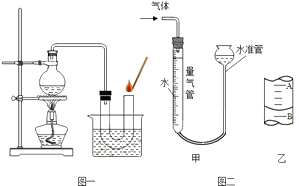
��һ��ʵ�飺С����֤����˫��ˮ�Ƿ�ʧЧ��
��1��ʵ�����
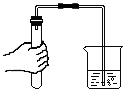
�����Թ��м���5mL��˫��ˮ�����Ѵ����ǵ�ľ�������Թ��У�����ľ��δ��ȼ��
���þƾ��Ƹ������Թܼ��ȣ�Һ���������ݲ������Ѵ����ǵ�ľ�������Թ��У�����ľ����δ��ȼ��
�۰�ͼһװ�ý��в����������ǵ�ľ����ȼ��ˮ���б�ˮ����������� ��
��2��ʵ����ۣ� ��
�ڶ���ʵ�飺С����̽��Fe2O3�ܷ���ΪH2O2�ֽ�Ĵ���������MnO2�Ĵ�Ч�����бȽϣ�С����С�С����λͬѧͬʱ����H2O2�ķֽ���������ռ�ʵ�飮ʵ��ʱ�����30����������Ϊ��H2O2��δȫ���ֽ⣩����ͼ���ף�����������Ӱ��ʵ������ؾ����ԣ�����������£�
ͬѧ��� | ����������ͬ��H2O2��Һ | ��Һ�м�������� | �ռ������������ |
С�� | 100mL | δ���������� | a ml |
�� | 100mL | Fe2O3 0.5g | b ml |
�� | 100mL | MnO2 0.5g | c ml |
��50mL��������Һ���λ����ͼ������ʾ��A��B�̶ȼ����1mL���̶�AΪ20�����ʱ��������ΪmL��
��3����̽��Fe2O3��ʵ�����Ƿ�������ã�����Ӧ�Ƚ�����ѡ��a��b��c��գ��Ĵ�С��
���貹��������ʵ�飨����д������������裩�������� ��
ʵ����ۣ�Fe2O3�ܼӿ�H2O2�ķֽ⣬������ã�
ͨ���Ƚ�Fe2O3 ��MnO2 �ڷ�Ӧ�еķ�Ӧ���ʣ�����Fe2O3 �Ĵ�Ч��û�ж������̺ã�
���𰸡�
��1������ˮ����
��2��˫��ˮû��ʧЧ��31.8
��3��a��b���������ڻ�ѧ��Ӧǰ��ѧ�����Ƿ����ı䣻�������������ڷ�Ӧǰ���Ƿ����ı�
���������⣺��һ��ʵ�飨1���ڼ���ʱˮ�����������ܸ���ʵ���������Լ��������������ˮ����������2�����ݴ����ǵ�ľ����ȼ���Եó��ù�������û��ʧЧ�ڶ���ʵ�飨1��AΪ20mL����Һ��ʾ��Ϊ19.2mL������������50mL��19.2mL=31.8mL��2����̽��Fe203��ʵ�����Ƿ�������ã�Ҫ�Ƚ�С����С�Ӧ�ٶȵĿ�����Ҫ�����ʵ�飬���ݺ����Fe203�Ļ�ѧ������û�иı��֪����Ƶ�ʵ������ǽ����������˳��������Ƿ��ܼ�������������Ĵ�������Ҫ��һ�������Ƿ�ı䣮���Դ��ǣ���һ��ʵ�飺��1��������ˮ��������2����˫��ˮû��ʧЧ�ڶ���ʵ�飺��1��31.8����2��a b �������ڻ�ѧ��Ӧǰ��ѧ�����Ƿ����ı䣻�������������ڷ�Ӧǰ���Ƿ����ı�
�����㾫�������ڱ��⿼��Ĵ������ص�������ã���Ҫ�˽��������ý�����ڻ�ѧ��Ӧ���ܸı��������ʵĻ�ѧ��Ӧ���ʣ��������������ͻ�ѧ�����ڷ�Ӧǰ��û�з����仯�����ʣ���һ�������䣩�����ڻ�ѧ��Ӧ����������ýд����ò��ܵó���ȷ�𰸣�

����Ŀ��ijУ̽��С����������ĩ�����������̽������
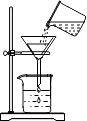
��1������һ��ѡ����ͼ��ʾ������װһ��ʵ������ȡ����������CO����װ�ã�����֤���ʡ�
����ѡ����������˳��Ϊ(��д���������ĸ)��
������Fװ���ռ�CO2 �� ����Ӧ��(��a��b)�˹ܿڽ��롣
�۽�CO2ͨ�뵽Dװ���У��ɹ۲쵽����������
�ܽ�CO2ͨ�뵽ʢ������ˮ��ϴ��ƿ�У�һ��ʱ�����ϴ��ƿ����Һ��pH7(�>������=������<��)��
�ݽ�CO2ͨ�˵�NaOH��Һ�п�����ȡNa2CO3 �� ��д����ѧ����ʽ��
��2���������̽������̼���ƵĻ�ѧ���
���������ϡ���Na2CO3��H2O2��ϣ���һ��������ȡ����̼���ƣ�����Ư��ϴ�Ӽ�������̼����(��Է�������Ϊ122)��һ�ְ�ɫ�����ĩ��������ˮ������ˮ��Ӧ����Na2CO3��һ�ֵ��ʡ�
Ϊ��̽������̼���ƵĻ�ѧ��ɣ�ͬѧ�����������ʵ�飬����ɱ������ݡ�
��� | ʵ�鲽�� | ʵ������ | ʵ����ۻ���� |
�� | ��ʢ�й���̼���ƹ�����Թ��м�������ˮ | �����ܽ� | ����̼��������ˮ������ˮ��Ӧ�� |
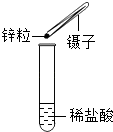
�� | ����Ţٵ�������Һ�м���������MnO2��ĩ | �д������ݲ��� | MnO2���������� |
�� | �������ǵ�ľ�������Թܿ� | ľ����ȼ | ����̼������ˮ��Ӧ���ɵĵ�����(�ѧʽ)�� |
�� | ȡ��Ţ��Թ��е��ϲ���Һ����CaCl2��Һ | ������ɫ���� | ��Ӧ�Ļ�ѧ����ʽΪ�� |
ʵ��С�� | �������̼���ƵĻ�ѧʽ���� | ||
����Ŀ����������ѧ��ȤС���ͬѧ���α��ϵ�ʵ��װ�������ⶨ���������������������ʵ�飨��ͼ����ʾ������������������������������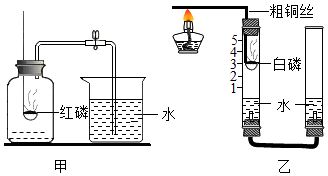
�������̽����
�������������������С�����֮һ
��������⡿�������ԭ����ʲô����θĽ��α��ϵ�ʵ��װ�ã�
���������ϡ����ס�����һЩ�������±���
��ɫ��״̬ | �۵�/�� | �Ż��/�� | �ܶȣ�g/cm3�� | |
���� | ����ɫ���� | 590 | 240 | 2.34 |
���� | ��ɫ���ɫ���� | 44.1 | 40 | 1.82 |
��1������������衿Aͬѧ�������ǵ�����ԭ���п������������������ˮ��Ӱ��ʵ���ȷ�ԣ�
Bͬѧ��������ƿ�ڲ��������л���������
�㻹�������IJ����� ��
��2�������������ۡ������ǶԿα��ϵ�ʵ��װ�ý�����ͼ����ʾ�ĸĽ��������������ԣ���
��α��ϵ�ʵ��װ����Ƚϣ���װ�õ�һ���ŵ��� ��
���ܵó�����������Լռ���֮һ�����ʵ�������� ��
����ͬѧ�ӿα�þ��ȼ��ʵ��õ���������þ������ף�ʵ����ϣ���ȴ�����ˮ�����Զ�������ݻ���1/5��
��3������������衿����þ���뵪�������˷�Ӧ
�����ʵ�顿Ϊ����þ���ܷ���N2��ȼ�գ���ȤС��չ������̽����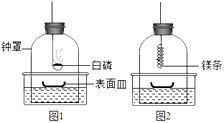
����װ������ͼ1�������¶��ף�����������ԣ���ˮ���м�ˮ���۲쵽����˵�����������ã�
�ڽ����������ڿ����е�ȼ��Ѹ�����������ڣ�������Ƥ����
�۴�������ˮ�治�ٱ仯ʱ����ˮ���м�ˮ��ʹˮ����Һ����������Һ����ƽ��
�ܴ���Ƥ������ȼ�ŵ�����״þ��Ѹ�����������ڣ�������Ƥ����ͼ2�����۲�Һ��仯��
���������ۡ�
a.��������������õ���������
b.�����Ŀ������
c.����ܹ۲쵽����˵��þ���뵪����Ӧ��
��4������˼������С��ͬѧ��Ϊֻ����ͼ2ʵ�飬�������ڽ���ˮ������������ݻ��� ![]() ������˵��þ�������������������˷�Ӧ���Դ˹۵�����Ϊ�Ƿ���ȷ��˵������ ��
������˵��þ�������������������˷�Ӧ���Դ˹۵�����Ϊ�Ƿ���ȷ��˵������ ��
��5������չ����þ�뵪����Ӧ���ɵ���þ��Mg3N2�������������ȵ������ã�����þȼ�����ɵĵ���þ����������þ����С����
��8gþ�ڿ�����ȼ�գ�����30%��þ���ɵ���þ�����㵪��þ������ ��д��������̣���