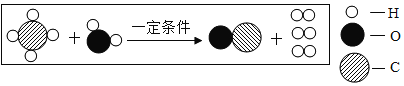
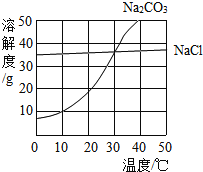
��Ŀ����
����Ŀ��Ϊ�˲ⶨ����ʯ��Ʒ��̼��Ƶ���������(���ʲ�����Ԫ�أ�������ˮ��Ҳ�����������ʷ�����Ӧ��������������ʵ�飺��ش��������⣺
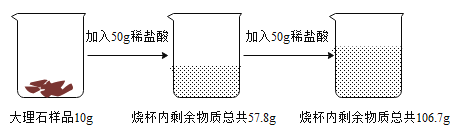
��1��д������ʵ���з�����Ӧ�Ļ�ѧ����ʽΪ_____��
��2��������֪�����г����10g ����ʯ��Ʒ��̼���������x���ı���ʽΪ_____��
��3���ô���ʯ��Ʒ��̼��Ƶ�����������_____��
��4������ʵ��������Ҫϡ���ᣬ��Ҫ��������Ϊ 36.5%��Ũ�����������_____��
��5�������õĹ�Һ�������ˣ�������Һ���� 6.8g ˮ�����ʱ��Һ���Ȼ��Ƶ�����������_____��
��6��ij����Ҫ���Ƶ� 280t ������ 25%�������ƣ���������Ҫ���ִ���ʯ������Ϊ_____��
���𰸡���1��![]() ����2��
����2��![]() ����3��75%����4��20g����5��7.5%����6��500t
����3��75%����4��20g����5��7.5%����6��500t
��������
��1��ʵ���з�����Ӧ̼�����ϡ���ᷴӦ�����Ȼ��ơ�������̼�����ˮ����ѧ����ʽΪ![]() ��
��
��2���⣺��10g ����ʯ��Ʒ��̼�������Ϊx��
���ɶ�����̼���������Ϊ![]()
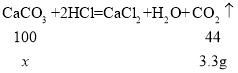
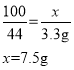
�ɴ˿�֪��10g ����ʯ��Ʒ��̼���������x���ı���ʽΪ��![]() ��
��
��3���ô���ʯ��Ʒ��̼��Ƶ���������Ϊ��![]() ��
��
��4����50gϡ�����к��Ȼ��������Ϊy��
��һ�μ���50gϡ��������Ķ�����̼���������Ϊ��![]()
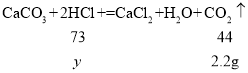
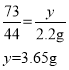
������ʵ��������Ҫϡ���ᣬ��Ҫ��������Ϊ36.5%��Ũ�����������![]() ��
��
��5������Һ���Ȼ��Ƶ�����Ϊz��
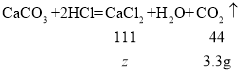
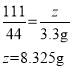
����Һ���Ȼ��Ƶ���������Ϊ![]() ��
��
��6������Ҫ���ִ���ʯ��̼��Ƶ�����Ϊm��
���ɵ������Ƶ�����Ϊ![]()
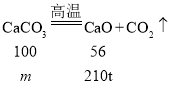
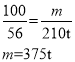
����������Ҫ���ִ���ʯ������Ϊ��![]() ��
��