��Ŀ����
����Ŀ��ij��ȤС����̽��������ѧ����ʱ����п�ۺ����۵Ļ������뵽ʢ��һ����������������ͭ��Һ���ձ��У���ַ�Ӧ����ˣ��õ���������Һ��ʵ������ͼ1��ͼ2�����������ش��������⣺
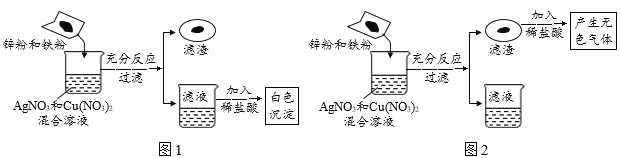
��1��ͼ1������Һ�м���ϡ���ᣬ�۲쵽�а�ɫ����������
����Һ��һ�����еĽ�������Ϊ_____�������ӷ��ţ���
��д��һ�����������ķ�Ӧ�Ļ�ѧ����ʽ_____��
��2��ͼ2���������м���ϡ���ᣬ�۲쵽����ɫ���������
��������һ������_____���ѧʽ����ͬ����
����Һ�п��ܺ���_____��
���𰸡�Ag+��Cu2+��Fe2+��Zn2+ Zn+2AgNO3=Zn(NO3)2+2Ag��Fe+2AgNO3=Fe(NO3)2+2Ag Ag��Cu��Fe Fe(NO3)2
��������
�ɽ������˳�����֪��п>��>ͭ>����������������Һ��Ӧ��һ����ѭλ����ǰ�Ľ����ܽ�λ�����Ľ�����������Һ���û����������ֽ����Ͷ�������Һ��Ӧʱ�������˳����о���ԽԶ������Խ�ȷ�Ӧ��������֮��ķ�Ӧ˳���ǣ�1.������������2.п����������3.��������ͭ��4.п������ͭ��5.п����������������˼·���н��
(1) ����Һ�м���ϡ���ᣬ�۲쵽�а�ɫ����������˵����Һ����Ag+������ʵ��������������������п������������Ӧ�꣬�ֱ�ת����Fe2+��Zn2+������ͭû�μӷ�Ӧ������Һ��һ�����еĽ�������Ϊ��Ag+ ��Cu2+��Fe2+��Zn2+��
������������Ӧ������������������п����������Ӧ��������п��������ѧ����ʽ�ֱ�Ϊ��Zn+2AgNO3=Zn(NO3)2+2Ag��Fe+2AgNO3=Fe(NO3)2+2Ag��
(2) �������м���ϡ���ᣬ�۲쵽����ɫ���������˵�������˵������Ӧ������������п������ȫ��Ӧ�꣬��������һ������Ag��Cu��Fe��
��Ϊп��ȫ��Ӧ�������Һ��һ��������п���Ƿ�������������Ҫ�������������Ƿ����������Һ�п��ܺ��У�Fe(NO3)2

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����Ʊ�����ʵ��̽������Ҫ����������ʵ����������ﵽʵ��Ŀ�ĵ��ǣ�������
|
|
|
|
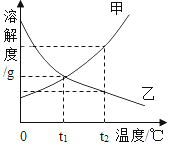
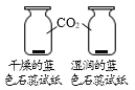
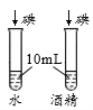
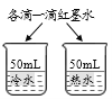
A��̽������þ�������ǿ�� | B��̽��������̼��ˮ�Ƿ�����Ӧ | C��̽����ͬ�ܼ��������ܽ��Դ�С | D��̽���¶ȶԷ����˶�������Ӱ�� |
A. AB. BC. CD. D