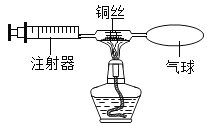
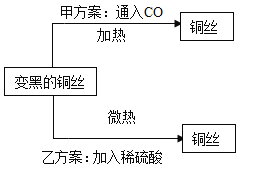
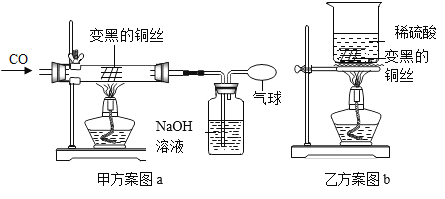
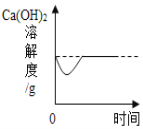
题目内容
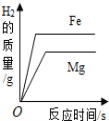
【题目】将锌粉和铁粉加入一定量的硝酸铝和硝酸银的混合溶液中,充分反应后过滤。
(1)写出一定发生的反应的化学方程式。_____
(2)若滤液呈浅绿色,请写出所得固体中一定没有的金属。_____
【答案】![]() 铝、锌
铝、锌
【解析】
在金属活动性顺序中,铝>锌>铁>银,锌先与硝酸银反应生成硝酸锌和银,待锌完全反应后,铁再与硝酸银反应生成硝酸亚铁和银,锌、铁都不会与硝酸铝反应。
(1)由分析可知,一定发生的反应是锌与硝酸银反应生成硝酸锌和银,化学方程式为![]() ;
;
(2)若滤液b呈浅绿色,说明铁已经与硝酸银发生了反应生成了硝酸亚铁,锌已经完全反应,铁可能置换了部分硝酸银或铁恰好与硝酸银完全反应,这时所得固体为银,铁也可能过量,这时所得固体为铁、银,所以固体中一定含有银,可能含有铁,一定没有铝、锌。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】小美网购了一种管道疏通剂, 其主要成分是氢氧化钠和碳酸钠中的一种或两种。小美和兴趣小组同学对这种管道疏通剂的成分进行了探究:
[提出问题]该管道疏通剂的成分是什么?
[猜想]猜想一:碳酸钠;
猜想二:氢氧化钠;
猜想三:氢氧化钠和碳酸钠。
[设计与实验] (假设管道疏通剂中其他成分不影响其主要成分的检测)
本次实验所需试剂只能从下列试剂中选择:蒸馏水,澄清石灰水、氯化钡溶液、稀盐酸、 氯化铜溶液、酚酞溶液。
方案 | 操作 | 现象 | 结论 |
一 | 取一包装良好的管道疏通剂,拆开包装,取样于试管中,加水溶解,滴入澄清石灰水 | 出现白色沉淀 | 猜想一正确,反应的化学方程式为__________ |
二 | 取一包装良好的管道疏通剂,拆开包装,取样于试管中,加入适量的水溶解,再滴加足量的________溶液后,取上层清液滴入酚酞试液 | ____________ | 猜想三正确 |
[讨论]小组同学认为方案一的结论不严谨, 理由是_________________。
[拓展](1)结合上述探究分析,这种管道疏通剂不能与皮肤接触,其原因是_____________。
(2)为定量测定这种管道疏通剂中碳酸钠的含量,小美设计如图所示实验,小江认为实验时不用检查装置气密性,你同意小江的观点吗?并说明理由______________________。
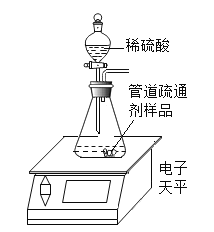
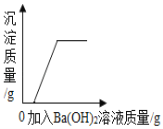
【题目】为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:①在三个烧杯中都加入了11g样品及足量的水配成溶液;②向三个烧杯中加入质量不等的CaCl2粉末;③将充分反应后生成的沉淀过滤、洗涤、干燥得到wg的白色固体.实验数据如下:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入CaCl2的质量/g | 5.55 | 12 | 15 |
W/g | 5 | 10 | 10 |
回答下列问题:
(1)将烧杯Ⅲ中的溶液蒸干,得到 g固体,该固体由 和 组成(只填化学式).
(2)样品中碳酸钠的质量分数是多少?
【题目】某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把100 g稀盐酸分5次加入,测量过程所得数据见下表(已知石灰石样品中杂质不溶于水,不与稀盐酸反应),各次稀盐酸用量和反应后剩余固体质量记录如下:
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
实验后剩余固体的质量/g | 13 | 10 | 7 | 6 | m |
请回答:
(1)上表中m的数值为 。
(2)石灰石样品中碳酸钙的质量分数为多少?
(3)在第5次实验后的溶液中,再加人足量的该石灰石样品粉末,完全反应后过滤,求所得溶液的溶质质量分数。(假设实验过程中溶液损失忽略不计)
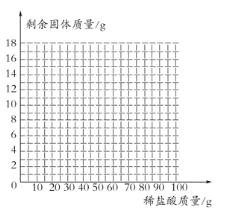
(4)画出16g样品中加入稀盐酸的质量和剩余固体的质量关系的示意图 (不用写出计算过程。)
(5)第一次加入20 g盐酸的反应速率为ν1,第二次加入20g盐酸的反应速率为ν2,则ν1 ν2(选填“>”“<”或“=”)。