题目内容
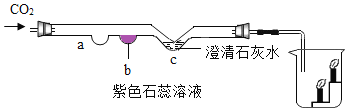
【题目】根据下面的实验过程和提供的数据,回答下列问题。(不考虑反应中水分的蒸发,假设生成的气体全部逸出)
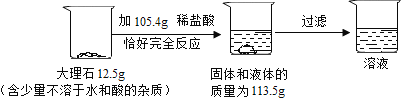
(1)生成的二氧化碳的质量_____g。
(2)过滤后所得溶液中溶质CaCl2 的质量分数_____(精确至0.1%)。
【答案】4.4 10.0%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸钙和氯化钙的质量,进而求算对应的质量分数。
(1)根据质量守恒定律,二氧化碳的质量为:12.5g+105.4g﹣113.5g=4.4g;故填:4.4。
(2)解:设该石灰石样品中碳酸钙的质量为x,生成氯化钙的质量为y。
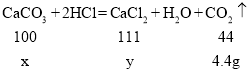
![]()
x=10g
![]()
y=11.1g
过滤后所得溶液中溶质CaCl2的质量分数为:![]()
答:过滤后所得溶液中溶质CaCl2的质量分数10.0%。

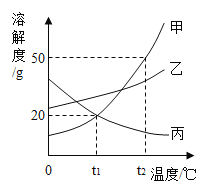
【题目】如图所示,在分别盛有100g水的烧杯中放入KNO3充分溶解,则说法正确的是( )
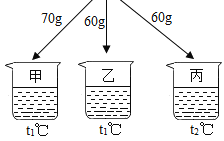
温度(℃) | t1 | t2 |
KNO3的溶解度(g/100g水) | 60 | 90 |
A.甲、乙、丙均为饱和溶液B.乙升温至t2℃,溶液质量增加
C.甲、乙、丙溶液中溶质质量相等D.丙溶液的溶质质量分数是60%
【题目】下图是芸芸(甲)、绪绪(乙)两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。
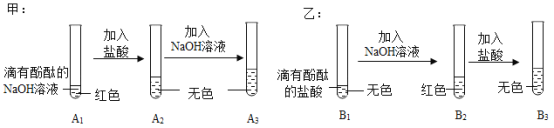
(说明:图中 A1、A2、A3、B1、B2、B3 均为溶液编号) 根据上图实验,请你与芸芸、绪绪同学一起完成下列探究:
探究环节 | 芸芸同学的探究 | 绪绪同学的探究 |
提出问题 | A3 溶液为什么不变红? | B3 溶液中溶质成分是什么?(酚酞不计) |
作出猜想 | 实验过程中,酚酞变质了。 | 猜想一:NaCl 猜想二:NaCl、HCl |
实验验证 | (1)取少量 A3 溶液于另一试管中,向其中滴 加 NaOH 溶液,溶液变红,说明芸芸同学的 猜想_____(填“成立”或“不成立”)。 (2)你认为,在常温下 A2 溶液测出的 pH 应_____(填“>”、“=”或“<”)7。 | 取少量 B3 溶液加入盛有少量铁粉的试管 中,观察到有无色气泡产生,固体逐渐减 少,溶液由无色变为_____。据此,你 认为绪绪同学的猜想_____(填“一”或 “二”)成立。 |
交流反思 | (1)芸芸、绪绪同学的实验中,反应均涉及到的化学方程式是_____。 (2)A3 溶液未变红,你认为原因是 A2 溶液中_____较多,加入的 NaOH 溶液 未将其完全中和。 (3)芸芸、绪绪同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。 | |