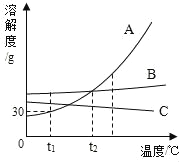
题目内容
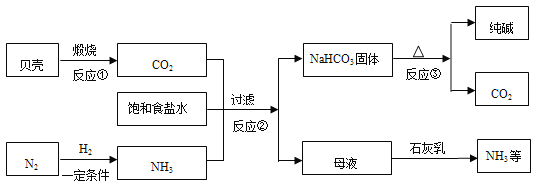
【题目】某废水中含有AgNO3、Ca(NO3)2、Fe(NO3)2、Cu(NO3)2、NaNO3几种物质。为了回收金属,同时得到较纯的硝酸钠,保护环境,化学小组的同学设计了一个处理该废水的实验方案,流程如下:

[查阅资料]白色的Fe(OH)2沉淀在潮湿空气中会迅速转化为红褐色的Fe(OH)3。
(1)操作X的名称是_______。
(2)操作中加入过量金属Fe,用铁粉末比铁片更好,其原因是_____,加入过量金属Fe可以除去废水中的______。
(3)溶液C中含有的阴离子有______。
(4)写出白色的Fe(OH)2沉淀转化为红褐色Fe(OH)3反应的化学方程式:______。
(5)化学兴趣小组对以上流程得到的NaNO3液进行检测,分析后可知得到的NaNO3溶液不纯,含有杂质,则最后得到的NaNO3溶液所含的杂质是_____。
【答案】过滤 增大反应物接触面积,充分反应 AgNO3、Cu(NO3)2 NO3-、OH- 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Na2CO3、NaOH
【解析】
(1)操作X将混合物分离得到固体和溶液,所以操作X是过滤。
故填:过滤。
(2)铁粉优点是增大反应物间的接触面积,使反应更快、更充分,铁的活动性较银和铜强,可将银和铜从它们的化合物溶液中置换出来,所以加入过量的铁粉可除去硝酸银和硝酸铜。
故填:增大反应物接触面积,充分反应;AgNO3、Cu(NO3)2。
(3)溶液B中的溶质是硝酸亚铁、硝酸钠和硝酸钙,加入过量的氢氧化钠后,硝酸亚铁转化为氢氧化亚铁,所以溶液C中含有的溶质是硝酸钠、硝酸钙、氢氧化钠,对应的阴离子是硝酸根离子和氢氧根离子。故填:NO3-、OH-。
(4)氢氧化亚铁在空气中转化为氢氧化铁,反应物中一定有氢氧化亚铁,生成物是氢氧化铁,分析可知,该反应的反应物为氢氧化亚铁、水和氧气,生成物为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
故填:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)由于加入的氢氧化钠和碳酸钠均过量,后续操作中对过量的氢氧化钠和碳酸钠未进行处理,所以最终所得硝酸钠溶液中还有碳酸钠和氢氧化钠。
故填:Na2CO3、NaOH。

 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】做完加热铜片的实验后,小明同学对其成分进行分析。取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应,每次所用稀硫酸的质量及剩余固体的质量记录于下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
充分反应后剩余固体的质量/g | 9.2 | 8.4 | 7.6 | 7 | 7 |
试回答下列问题:
(1)10g样品中氧化铜的质量为__________g。
(2)计算所加入稀硫酸中溶质的质量分数____________________。
【题目】某课外兴趣小组为探究一久置的铝片中铝元素的质量分数,他们取8g该铝片样品放入烧杯中,并依次加入一定质量的相同浓度的稀盐酸,测得相关数据如下,请回答问题。
实验次数 | 1 | 2 | 3 | 4 | 5 |
每次加入稀盐酸的质量/g | 50.0 | 100.0 | 100.0 | 100.0 | 100.0 |
产生气体的总质量/g | 0 | 0.2 | a | 0.6 | 0.7 |
(1)a的数值为_______。
(2)计算所用稀盐酸的溶质质量分数______ (结果保留至0.1%,下同) 。
(3)求该铝片中铝元素的质量分数______。