��Ŀ����
����Ŀ��ˮ��Ⱦ������ǵ���������Ҫ��ע�Ļ�������֮һ����ũҵ��ˮ��������ˮ��ˮ��Ⱦ����Ҫ��Դ���ش��������⣺
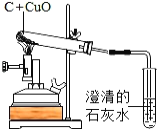
(1)����________(������������������)��Ⱦˮ�壬úȼ�ղ���SO2��SO2�γ��������Ҫԭ����________��
(2)�Ͼɵ���к��еĹ����ӵ��ؽ�������Ⱦˮ�壬����������ж�����ԭ�����ؽ�����ʹ�������ڵ�________(�ѧ����)�ṹ�ƻ���ʧȥ�������ԡ�
(3)ij��ҵ��ˮ��HgSO4����ͨ���������������£����Ƚ����γ������������á��䷴Ӧ�Ļ�ѧ����ʽΪ________�����ķе�________(��������������������)���ķе㡣Ҳ�������ˮ�м���Na2S��Һ�γɳ�������ȥ�����ó����Ļ�ѧʽΪ________��
(4)�׳���ˮ���������������Ϊ0.98%��������Ϊ45kg/s���ҳ���ˮ���ռ����������Ϊ0.4%��Ϊ�ŷŴ�꣬�ֽ���������ˮ��ϴ�������Ӧ�Ļ�ѧ����ʽΪ________�����ҳ���ˮ���������Ϊ________kg/s��
���𰸡��� SO2��ˮ��Ӧ���������ᣬ��������һ����Ӧ�������ᣬʹ��ˮ��pH��5.6 ������ HgSO4+Fe=Hg+FeSO4 ���� HgS 2NaOH+H2SO4=Na2SO4+2H2O 90
��������
(1)��������ԣ�����Ⱦˮ�壻úȼ�ղ���SO2��SO2��ˮ��Ӧ���������ᣬ��������һ����Ӧ�������ᣬʹ��ˮ��pH��5.6������ܣ�SO2��ˮ��Ӧ���������ᣬ��������һ����Ӧ�������ᣬʹ��ˮ��pH��5.6
(2)�Ͼɵ���к��еĹ����ӵ��ؽ�������Ⱦˮ�壬����������ж�����ԭ�����ؽ�����ʹ�������ڵĵ����ʽṹ�ƻ���ʧȥ�������ԣ���������ʣ�
(3)HgSO4��Fe��Ӧ����Hg��FeSO4����ѧ����ʽΪ��HgSO4+Fe=Hg+FeSO4����������е���Ϣ��֪���ķе�������ķе㣻Ҳ�������ˮ�м���Na2S��Һ�γɳ�������ȥ�����ó����Ļ�ѧʽΪHgS�����HgSO4+Fe=Hg+FeSO4�����ڣ�HgS
(4)����������������������ƺ�ˮ����ѧ����ʽΪ��2NaOH+H2SO4=Na2SO4+2H2O��
���ҳ���ˮÿ�������������Ϊx��
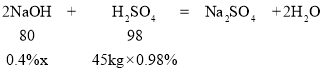
![]()
x=90kg�����90

����Ŀ������Ϊ������֮Դ����ˮ��H2O���ͱ���Ϊ����ɫ���������Ĺ������⣨H2O2����ͨ������¾�Ϊ��ɫҺ�塣�ڻ�ѧʵ���ж��к���Ҫ�����á�
��1��ָ������ʵ��������ˮ����Ҫ����
A��____________________________________
B��____________________________________
C��____________________________________
��2������ˮ����������ƿ��ɫҺ�壬����д�й����ݣ�
ʵ�鲽�� | ʵ������ | ʵ����� |
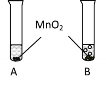
1. ���������������ɫҺ��ֱ����A��B�����Թ��С� 2. | A�Թ������������� B�Թ��������ݲ��� | A�Թ��е���ɫ Һ����_____�� |
��B�Թ��з�����Ӧ�����ֱ���ʽ�ǣ�_______________ ��
�����ϼ�������ˮ���������в�ͬ��ѧ���ʣ����ǻ�ѧ���ʲ�ͬ��ԭ����______��
��3��̽��Ӱ���������ֽ����ʵ����أ�������ʵ����ʹ�õ���Һ���ǹ���������Һ��
̽��ʵ��һ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ��
ʵ�鲽�� | �� �� |
1��ȡһ֧�Թܼ���5g��5%����Һ��Ȼ�����1g�������̡� | ��������������ð�� |
2����ȡһ֧�Թܼ��� | Ѹ���д�������ð�� |
Ϊ��֤̽�������ȷ�ԣ�ʵ�鲽��2�ĺ����ϵ�������__________ ��ͨ��ʵ�鷢�֣�������������ͬʱ�����������Ũ��Խ�ߣ��ֽ������____ ��
̽��ʵ�����
��� | ��ҺŨ�� | ��Һ����/g | �¶�/�� | �ռ����������/ml | ��Ӧʱ��/S |
1 | 30% | 12 | 40 | 125 | 148 |
2 | 30% | 12 | 90 | 125 | 82 |
��ʵ���Ŀ����̽��_________________ �Թ�������ֽ����ʵ�Ӱ�졣