题目内容
实验室常用稀盐酸和大理石制取二氧化碳气体.现需收集4瓶(每瓶以125mL计算)二氧化碳气体,问至少需要多少克大理石(含碳酸钙80%)与足量的稀盐酸反应才能制得?(实验条件下二氧化碳的密度为2g?L-1,结果保留一位小数)
【答案】分析:根据反应的化学方程式,由收集二氧化碳的质量计算反应消耗碳酸钙的质量,利用大理石中碳酸钙的含量计算需要大理石的质量.
解答:解:收集4瓶二氧化碳的质量=125mL×4×1×10-3L/mL×2g/L=1g.
设参加反应的碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1g
 =
=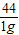
x≈2.27g
需要大理石的质量=2.27g÷80%≈2.8g.
答:至少需要约2.8g大理石(含碳酸钙80%)与足量的稀盐酸反应才能制得.
点评:根据反应的化学方程式进行计算时,所使用物质的质量必需为纯净物的质量,不纯物质的质量不能直接代入化学方程式进行计算.
解答:解:收集4瓶二氧化碳的质量=125mL×4×1×10-3L/mL×2g/L=1g.
设参加反应的碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1g
 =
=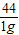
x≈2.27g
需要大理石的质量=2.27g÷80%≈2.8g.
答:至少需要约2.8g大理石(含碳酸钙80%)与足量的稀盐酸反应才能制得.
点评:根据反应的化学方程式进行计算时,所使用物质的质量必需为纯净物的质量,不纯物质的质量不能直接代入化学方程式进行计算.

练习册系列答案
相关题目
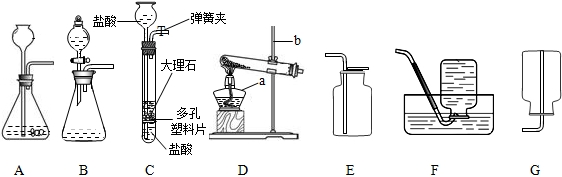


 实验室常用稀盐酸和石灰石反应制取二氧化碳.
实验室常用稀盐酸和石灰石反应制取二氧化碳.
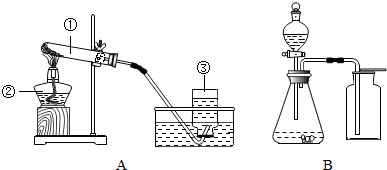 实验室常用如图所示装置制取有关气体.
实验室常用如图所示装置制取有关气体.