题目内容
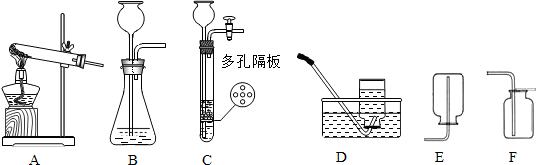
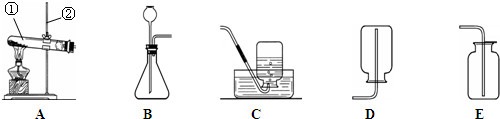
实验课上,同学们利用下列装置进行气体制备的学习.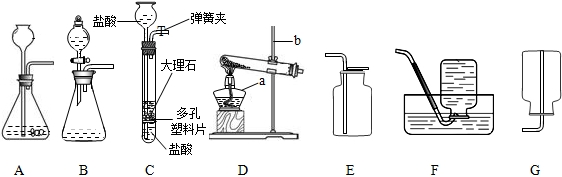
请你用已学的化学知识回答下列问题:
(1)图中仪器a的名称是
(2)在实验室里常用稀盐酸和块状大理石在装置A中反应制取二氧化碳,不用粉末状
大理石的原因是
(3)装置A、B和C都能制取二氧化碳气体,但装置C与前两者相比较,你认为装置C的优势是
(4)实验室用加热无水乙酸钠固体和氢氧化钠固体制取甲烷气体.在通常情况下甲烷是一种无色无味的气体,难溶于水,密度比空气小.现实验室制取较纯净的甲烷应选用的发生和收集装置是
(5)若用装置D制取氧气,则该反应的化学方程式为
(6)在实验室常用装置B来制取氧气,现用510克5%的双氧水溶液制取氧气.试计算:
①若用30%的双氧水溶液加水稀释,配制510克5%的双氧水溶液,需要30%双氧水溶液
②510克5%的双氧水溶液中含双氧水
③若上述②中双氧水完全分解,可制得氧气多少摩尔?(请写出完整的解题过程)
分析:(1)识别仪器.
(2)粉末碳酸钙和盐酸接触面积大,反应较快,气体不好收集,因此用大理石固体.
(3)比较发现C多一个弹簧夹和隔板,一旦关闭弹簧夹,随着气体的增多,会是液体和固体分离,反应停止.
(4)根据发生装置和收集装置的选择条件即可.
(5)根据质量守恒定律可知,反应后固体物质的质量减小了,所以二氧化锰的质量分数增大.
(6)根据化学方程式计算即可,注意规范.
(2)粉末碳酸钙和盐酸接触面积大,反应较快,气体不好收集,因此用大理石固体.
(3)比较发现C多一个弹簧夹和隔板,一旦关闭弹簧夹,随着气体的增多,会是液体和固体分离,反应停止.
(4)根据发生装置和收集装置的选择条件即可.
(5)根据质量守恒定律可知,反应后固体物质的质量减小了,所以二氧化锰的质量分数增大.
(6)根据化学方程式计算即可,注意规范.
解答:解:(1)识别仪器,故答案为:酒精灯、铁架台.
(2)粉末碳酸钙和盐酸接触面积大,反应较快,气体不好收集,所以用大理石固体.故答案为:化学反应速度太快来不及收集气体(或反应速率太快不易控制反应进行,不便于实验操作)等,CaCO3+2HCl═CaCl2+CO2↑+H2O.
(3)比较发现C多一个弹簧夹和隔板,一旦关闭弹簧夹,随着气体的增多,会是液体和固体分离,反应停止.故答案为:能使反应随开随用,随关随停(或随时使反应发生,随时使反应停止).
(4)实验室用加热无水乙酸钠固体和氢氧化钠固体制取甲烷气体,发生装置属于固体和固体加热制气体;甲烷不溶于水,可以采用排水法收集,故答案为:D F.
(5)根据质量守恒定律可知,反应后固体物质的质量减小了,但是二氧化锰的质量不变(催化剂),所以二氧化锰的质量分数增大.故答案为:2KClO3
2KCl+3O2↑,变大.
(6)①稀释前后溶质的质量不变,设需要30%双氧水溶液的质量为X,则X×30%═510×5%,得:X=85
②双氧水的物质的量:
═0.75(摩尔)
③设:可制得氧气为X摩尔.
2H2O2
2H2O+O2↑
2 1
0.75 x
═
x=0.375(摩尔)
答:可制得氧气为0.375摩尔.
(2)粉末碳酸钙和盐酸接触面积大,反应较快,气体不好收集,所以用大理石固体.故答案为:化学反应速度太快来不及收集气体(或反应速率太快不易控制反应进行,不便于实验操作)等,CaCO3+2HCl═CaCl2+CO2↑+H2O.
(3)比较发现C多一个弹簧夹和隔板,一旦关闭弹簧夹,随着气体的增多,会是液体和固体分离,反应停止.故答案为:能使反应随开随用,随关随停(或随时使反应发生,随时使反应停止).
(4)实验室用加热无水乙酸钠固体和氢氧化钠固体制取甲烷气体,发生装置属于固体和固体加热制气体;甲烷不溶于水,可以采用排水法收集,故答案为:D F.
(5)根据质量守恒定律可知,反应后固体物质的质量减小了,但是二氧化锰的质量不变(催化剂),所以二氧化锰的质量分数增大.故答案为:2KClO3
| ||
| △ |
(6)①稀释前后溶质的质量不变,设需要30%双氧水溶液的质量为X,则X×30%═510×5%,得:X=85
②双氧水的物质的量:
| 510×0.05 |
| 34 |
③设:可制得氧气为X摩尔.
2H2O2
| ||
2 1
0.75 x
| 2 |
| 1 |
| 075 |
| X |
x=0.375(摩尔)
答:可制得氧气为0.375摩尔.
点评:掌握发生装置和收集装置的选择条件,同时记住随时开始,随时停止的仪器特点,还有催化剂的质量前后不变.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目