题目内容
 实验室常用稀盐酸和石灰石反应制取二氧化碳.
实验室常用稀盐酸和石灰石反应制取二氧化碳.(1)该反应的化学方程式为
CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
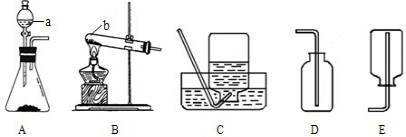
(2)图1表示加入药品前的一个操作,其目的是
为防止气体不纯或无法收集
为防止气体不纯或无法收集
.(3)写出检验生成的气体是二氧化碳的化学方程式:
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
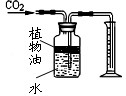
.(4)实验室通常不选用稀硫酸和石灰石反应制取二氧化碳,因生成的微溶物硫酸钙会阻碍反应的进一步进行.某小组经研究,用图2所示方法成功制得了大量CO2(反应物为稀硫酸和石灰石).
①使用图中收集二氧化碳方法的原因
二氧化碳气体能溶于水且密度比空气大
二氧化碳气体能溶于水且密度比空气大
.②该装置烧瓶和铁圈间垫有石棉网,作用是
使烧瓶受热均匀,防止炸裂
使烧瓶受热均匀,防止炸裂
.③推测:在硫酸溶液中加入氯化铵并对溶液加热,目的都是
增大硫酸钙在溶液中的溶解度
增大硫酸钙在溶液中的溶解度
.④有同学考虑盐酸和硫酸挥发性的差异,认为图2方法相比用稀盐酸和石灰石反应,改进的优点是
原方法中的盐酸具有挥发性,随二氧化碳溢出,干扰部分性质实验的完成
原方法中的盐酸具有挥发性,随二氧化碳溢出,干扰部分性质实验的完成
.(5)氯化钙是多用途的干燥剂和建筑防冻剂.实验室里用石灰石和盐酸制备二氧化碳的含酸废液(含有MgCl2、FeCl3等),通过以下途径制得无水氯化钙.

①操作 I的名称为
过滤
过滤
.滤渣的化学成分有Mg(OH)2、Fe(OH)3
Mg(OH)2、Fe(OH)3
.②用化学方程式表示石灰乳的作用(写一个)
中和废液中的酸
中和废液中的酸
.分析:(1)根据二氧化碳的实验室制法的反应原理CaCO3+2HCl=CaCl2+CO2↑+H2O进行解答;
(2)根据注意事项,如检查装置的气密性等进行解答;
(3)二氧化碳的检验方法,将生成的气体通入澄清石灰水,观察是否有变浑浊的现象进行解答;
(4)①根据二氧化碳气体能溶于水且密度比空气大进行解答;②根据烧瓶和铁圈间垫有石棉网,作用使烧瓶受热均匀进行解答;③实验室制取二氧化碳药品中的稀盐酸具有挥发性,导致产生的二氧化碳不纯,干扰部分性质实验的完成,因此改用稀硫酸与石灰石反应,但是反应中产生的硫酸钙微溶于水,因此本实验的改进中又加入了氯化铵和加热的目的应当是朝着有利于实验进行的方向发展的,可以推测目的是增大硫酸钙在溶液中的溶解度;④实验室制取二氧化碳药品中的稀盐酸具有挥发性,导致产生的二氧化碳不纯,干扰部分性质实验的完成;
(5)①根据混合物中颗粒的大小判断操作I的名称;根据反应方程式确定滤渣的成分;②根据石灰乳发生的反应判断其作用;
(2)根据注意事项,如检查装置的气密性等进行解答;
(3)二氧化碳的检验方法,将生成的气体通入澄清石灰水,观察是否有变浑浊的现象进行解答;
(4)①根据二氧化碳气体能溶于水且密度比空气大进行解答;②根据烧瓶和铁圈间垫有石棉网,作用使烧瓶受热均匀进行解答;③实验室制取二氧化碳药品中的稀盐酸具有挥发性,导致产生的二氧化碳不纯,干扰部分性质实验的完成,因此改用稀硫酸与石灰石反应,但是反应中产生的硫酸钙微溶于水,因此本实验的改进中又加入了氯化铵和加热的目的应当是朝着有利于实验进行的方向发展的,可以推测目的是增大硫酸钙在溶液中的溶解度;④实验室制取二氧化碳药品中的稀盐酸具有挥发性,导致产生的二氧化碳不纯,干扰部分性质实验的完成;
(5)①根据混合物中颗粒的大小判断操作I的名称;根据反应方程式确定滤渣的成分;②根据石灰乳发生的反应判断其作用;
解答:解:(1)二氧化碳的实验室制法的反应原理CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)为防止气体不纯或无法收集,实验前先检查装置的气密性;
(3)根据二氧化碳的检验方法,将生成的气体通入澄清石灰水,观察是否有变浑浊的现象,化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O;
(4)①二氧化碳气体能溶于水且密度比空气大,所以用向上排空气法收集;②烧瓶和铁圈间垫有石棉网,作用使烧瓶受热均匀,防止炸裂;③实验室制取二氧化碳药品中的稀盐酸具有挥发性,导致产生的二氧化碳不纯,干扰部分性质实验的完成,因此改用稀硫酸与石灰石反应,但是反应中产生的硫酸钙微溶于水,因此本实验的改进中又加入了氯化铵和加热的目的应当是朝着有利于实验进行的方向发展的,可以推测目的是增大硫酸钙在溶液中的溶解度;④实验室制取二氧化碳药品中的稀盐酸具有挥发性,导致产生的二氧化碳不纯,干扰部分性质实验的完成;
(5)①混合物中颗粒的大小判断操作I是过滤;含酸废液中含有酸、氯化镁、氯化铁等物质,加入石灰乳的目的是除去它们,反应的化学方程式为:2 FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2,MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,Mg(OH)2、Fe(OH)3都难溶于水,所以滤渣的化学成分有Mg(OH)2、Fe(OH)3;
②石灰乳参加的反应有:OH-+H═H2O,
2 FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2,
MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,
所以石灰乳的作用是:中和废液中的酸;使废液中的镁、铁充分沉淀.
故答案为:
(1)CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)为防止气体不纯或无法收集;
(3)CO2+Ca(OH)2=CaCO3↓+H2O;
(4)①二氧化碳气体能溶于水且密度比空气大;②使烧瓶受热均匀,防止炸裂;③增大硫酸钙在溶液中的溶解度;④原方法中的盐酸具有挥发性,随二氧化碳溢出,干扰部分性质实验的完成;
(5)①过滤;Mg(OH)2、Fe(OH)3;②中和废液中的酸.
(2)为防止气体不纯或无法收集,实验前先检查装置的气密性;
(3)根据二氧化碳的检验方法,将生成的气体通入澄清石灰水,观察是否有变浑浊的现象,化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O;
(4)①二氧化碳气体能溶于水且密度比空气大,所以用向上排空气法收集;②烧瓶和铁圈间垫有石棉网,作用使烧瓶受热均匀,防止炸裂;③实验室制取二氧化碳药品中的稀盐酸具有挥发性,导致产生的二氧化碳不纯,干扰部分性质实验的完成,因此改用稀硫酸与石灰石反应,但是反应中产生的硫酸钙微溶于水,因此本实验的改进中又加入了氯化铵和加热的目的应当是朝着有利于实验进行的方向发展的,可以推测目的是增大硫酸钙在溶液中的溶解度;④实验室制取二氧化碳药品中的稀盐酸具有挥发性,导致产生的二氧化碳不纯,干扰部分性质实验的完成;
(5)①混合物中颗粒的大小判断操作I是过滤;含酸废液中含有酸、氯化镁、氯化铁等物质,加入石灰乳的目的是除去它们,反应的化学方程式为:2 FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2,MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,Mg(OH)2、Fe(OH)3都难溶于水,所以滤渣的化学成分有Mg(OH)2、Fe(OH)3;
②石灰乳参加的反应有:OH-+H═H2O,
2 FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2,
MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,
所以石灰乳的作用是:中和废液中的酸;使废液中的镁、铁充分沉淀.
故答案为:
(1)CaCO3+2HCl=CaCl2+CO2↑+H2O;
(2)为防止气体不纯或无法收集;
(3)CO2+Ca(OH)2=CaCO3↓+H2O;
(4)①二氧化碳气体能溶于水且密度比空气大;②使烧瓶受热均匀,防止炸裂;③增大硫酸钙在溶液中的溶解度;④原方法中的盐酸具有挥发性,随二氧化碳溢出,干扰部分性质实验的完成;
(5)①过滤;Mg(OH)2、Fe(OH)3;②中和废液中的酸.
点评:综合实验题都设法推陈出新,重视考查创新意识和实践能力,重视考查解决问题的思维过程.对于实验设计评价的题型要注意是否具有科学性、安全性、可行性、环保性.另外解题过程中始终抓住问题的实质,以不变应万变.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 实验室常用稀盐酸和石灰石反应制取二氧化碳.
实验室常用稀盐酸和石灰石反应制取二氧化碳.