题目内容
通过化学学习,你已经掌握了实验室制取气体的一般规律,下列为实验室常用的实验装置,回答问题:

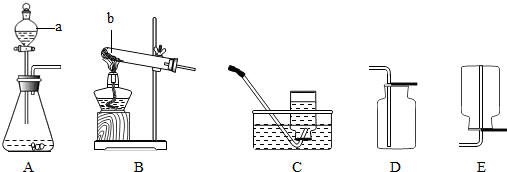
(1)写出图中标号的仪器名称:a
(2)实验室用高锰酸钾制取氧气时应选用
(3)实验室常用稀盐酸和石灰石反应制CO2,应选用的发生装置是
(4)二氧化碳能用于灭火,是因为它具有

(1)写出图中标号的仪器名称:a
分液漏斗
分液漏斗
,b试管
试管
;(2)实验室用高锰酸钾制取氧气时应选用
B
B
(填字母标号,下同)做气体发生装置;如果用D装置收集氧气,那么检验氧气是否收集满的方法是将带火星的木条放于集气瓶可,若木条复燃则收集满了
将带火星的木条放于集气瓶可,若木条复燃则收集满了
.实验室加热高锰酸钾制取氧气的化学方程式:2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
;属于
| ||
分解
分解
反应.(3)实验室常用稀盐酸和石灰石反应制CO2,应选用的发生装置是
A
A
,收集装置是D
D
.写出该反应的化学方程式CaCO3+2HCl=CaCl2+CO2↑+H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O
;此外,也可用加热碳酸氢钠(NaHCO3)固体来制取CO2,则应选用的发生装置为B
B
.(4)二氧化碳能用于灭火,是因为它具有
不能燃烧、不支持燃烧
不能燃烧、不支持燃烧
、密度比空气大
密度比空气大
的性质.分析:(1)根据常用仪器回答.
(2)根据实验室用高锰酸钾制取氧气时药品的状态、反应的条件,以及氧气的助燃性、反应原理回答;
(3)根据实验室制二氧化碳的原理、药品的状态和反应条件,二氧化碳的密度及溶解性,以及碳酸氢钠的状态和反应条件回答;
(4)根据二氧化碳的性质分析回答.
(2)根据实验室用高锰酸钾制取氧气时药品的状态、反应的条件,以及氧气的助燃性、反应原理回答;
(3)根据实验室制二氧化碳的原理、药品的状态和反应条件,二氧化碳的密度及溶解性,以及碳酸氢钠的状态和反应条件回答;
(4)根据二氧化碳的性质分析回答.
解答:解:(1)a是加入液体药品的仪器,有盖和活塞,是分液漏斗;b是少量试剂的反应容器,是试管;
(2)实验室用高锰酸钾制取氧气所用药品为固体,反应条件是加热,发生装置应选B;如果用向上排空气法收集氧气,验满时的操作方法为:用带火星的木条平放在集气瓶口,如带火星的木条复燃,则氧气已满;加热高锰酸钾生成锰酸钾、二氧化锰和二氧化碳,方程式是:2KMnO4
K2MnO4+MnO2+O2↑;该反应由一种物质生成三种物质,属于分解反应;
(3)实验室制二氧化碳所用药品是固态的石灰石与液态的稀盐酸,反应不需加热,气体发生装置选用A,二氧化碳能溶于水不能用排水法收集,因密度比空气大,可用向上排空气法,装置选用D;反应原理是碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;如用加热碳酸氢钠(NaHCO3)固体来制取CO2,药品状态为固体,条件为加热,发生装置要选用B;
(4)二氧化碳的密度比空气大、不能燃烧也不能支持燃烧,故可用来灭火;
故答案为:
(1)分液漏斗;试管;
(2)B;用带火星的木条平放在集气瓶口,如带火星的木条复燃,则氧气已满;2KMnO4
K2MnO4+MnO2+O2↑;分解;
(3)A;D;CaCO3+2HCl=CaCl2+CO2↑+H2O;B;
(4)不能燃烧、不支持燃烧;密度比空气大.
(2)实验室用高锰酸钾制取氧气所用药品为固体,反应条件是加热,发生装置应选B;如果用向上排空气法收集氧气,验满时的操作方法为:用带火星的木条平放在集气瓶口,如带火星的木条复燃,则氧气已满;加热高锰酸钾生成锰酸钾、二氧化锰和二氧化碳,方程式是:2KMnO4
| ||
(3)实验室制二氧化碳所用药品是固态的石灰石与液态的稀盐酸,反应不需加热,气体发生装置选用A,二氧化碳能溶于水不能用排水法收集,因密度比空气大,可用向上排空气法,装置选用D;反应原理是碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,方程式为:CaCO3+2HCl=CaCl2+CO2↑+H2O;如用加热碳酸氢钠(NaHCO3)固体来制取CO2,药品状态为固体,条件为加热,发生装置要选用B;
(4)二氧化碳的密度比空气大、不能燃烧也不能支持燃烧,故可用来灭火;
故答案为:
(1)分液漏斗;试管;
(2)B;用带火星的木条平放在集气瓶口,如带火星的木条复燃,则氧气已满;2KMnO4
| ||
(3)A;D;CaCO3+2HCl=CaCl2+CO2↑+H2O;B;
(4)不能燃烧、不支持燃烧;密度比空气大.
点评:气体的制取是初中重要的实验之一,是考查热点,理解反应原理,掌握装置的选择依据、气体的检验、验满、收集方法,了解实验步骤和注意事项是解决该类问题的关键.

练习册系列答案
相关题目
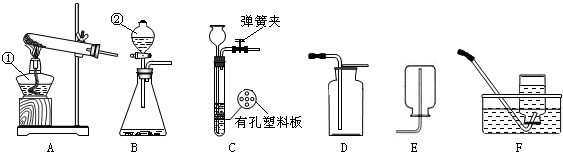
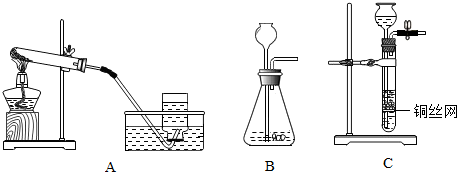
 通过化学学习,你已经掌握了实验室制取气体的一些规律,请结合下图回答问题:
通过化学学习,你已经掌握了实验室制取气体的一些规律,请结合下图回答问题: