题目内容
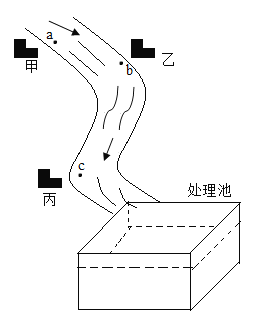
【题目】在一次实践活动中,某环保小组的同学对甲、乙、丙三个厂排出的废水进行探究,得知三个厂的废水中分别含有Na2CO3、NaOH、HCl中的任意一种,经实验获悉,a点的废水pH=3,甲厂废水流经b点,与乙厂废水相遇时,无明显现象,乙厂“排出的废水中溶质为_____。取少量处理池中废水,滴加几滴无色酚酞溶液呈红色。
[提出问题]处理池中水样含有哪些溶质?
[作出猜想]Ⅰ. NaCl、NaOH、Na2CO3 Ⅱ. NaCl、Na2CO3Ⅲ. NaCl、NaOH、HCl
小明质疑有一种猜想不合理,理由是_____。
[进行实验]小组同学设计了如下两个活动进行问题探究:
实验步骤 | 实验现象 | 实验结论 | |
活动一 | 取少量废水于试管中,向其中滴加足量_____,观察现象 | 有气泡产生 | 猜想Ⅱ正确 |
活动二 | ①取少量废水于试管中, 加入过量的_____溶液 | 白色沉淀 | 猜想I正确 |
②取上层清液,滴加几滴硫酸铜溶液 | _____ |
[反思评价]
(1)小明同学认为活动一不合理,理由是_____。
(2)活动二中②发生反应的化学方程式为_____。
(3)为了防止水体污染,请你对废水的综合利用提出一点合理化建议:_____(写一条)。
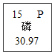
【答案】NaOH 处理池中废水呈碱性,猜想Ⅲ不可能含有HCl。 稀盐酸 氯化钙 有蓝色沉淀产生 猜想Ⅰ中有Na2CO3,遇到足量的盐酸也有气泡产生。 ![]() 处理池中的废水处理成中性,处理达标后排放
处理池中的废水处理成中性,处理达标后排放
【解析】
[题目]
a点的废水pH=3,甲厂废水中含有HCl,流经b点,与乙厂废水相遇时,无明显现象,HCl与氢氧化钠反应生成氯化钠和水,无明显现象,HCl与碳酸钠反应生成氯化钠、水和二氧化碳,有气泡产生,则乙厂“排出的废水中溶质为NaOH。
[作出猜想]
猜想Ⅲ. NaCl、NaOH、HCl,不合理,原因是取少量处理池中废水,滴加几滴无色酚酞溶液呈红色,废水呈碱性,不可能含有盐酸。
[进行实验]
(1)取少量废水于试管中,向其中滴加足量稀盐,观察到有气泡产生,证明废水有碳酸钠,盐酸与碳酸钠反应产生二氧化碳气体。
(2)取少量废水于试管中,加入过量的氯化钙溶液,有白色沉淀产生,说明废水含碳酸钠,氯化钙与碳酸钠反应生成碳酸钙白色沉淀,取上层清液,滴加几滴硫酸铜溶液,有蓝色沉淀产生,证明废水中还含有氢氧化钠,氢氧化钠与硫酸铜反应生成蓝色的氢氧化铜沉淀,得出猜想I正确。
[反思评价]
(1)活动一得出猜想Ⅱ正确,不合理,原因是猜想Ⅰ中有Na2CO3,遇到足量的盐酸也有气泡产生,无法证明猜想Ⅱ正确。
(2)活动二中②是滴加硫酸铜溶液,证明氢氧化钠的存在,发生反应的化学方程式为:![]() 。
。
(3)为了防止水体污染,合理建议:处理池中的废水处理成中性,处理达标后排放。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案