题目内容
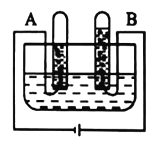
【题目】同学们为了探究氢氧化钙的化学性质,做了如下实验:
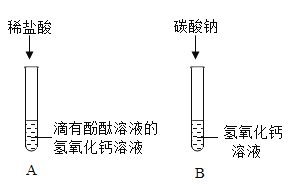
(1)试管A中观察到_____现象时,可证明氢氧化钙溶液与稀盐酸发生了反应。
(2)试管B中发生反应的化学方程式为_____;
(3)实验结束后,二支试管中的液体均为无色。同学们将二支试管中的无色液体倒入同一个洁净的烧杯中,静置一段时间,观察到烧杯底部有白色沉淀,上层溶液为无色。
[提出问题]无色溶液中除酚酞外还有哪些溶质?
[进行猜想]甲同学的猜想:NaCl
乙同学的猜想:NaCl、HCl
分析讨论]①经讨论,大家认为乙同学的猜想不正确,原因是_____;
②丙同学又提出了新的猜想,认为溶液中除氯化钠外,还可能含有_____,请你和丙同学一起验证他的猜想:
实验步骤 | 实验现象 | 实验结论 |
取少量无色溶液于试管_____ | _____ | 丙同学猜想正确 |
【答案】溶液由红色变成无色 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH CaCO3和HCl不能共存 氯化钙 滴加碳酸钠溶液 有白色沉淀生成
【解析】
稀盐酸和氢氧化钙反应生成氯化钙和水,碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠。
(1)无色酚酞试液在碱性溶液中呈碱性,当氢氧化钙和稀盐酸完全反应后,溶液会由红色变成无色。
(2)碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,反应的化学方程式为:
![]() 。
。
(3)①根据题目中所给信息可知白色沉淀是碳酸钙,溶液中不会含有HCl,所以乙同学的猜想不正确,故CaCO3和HCl不能共存。
②反应过程中如果氯化钙过量,反应后的溶液中还可能有氯化钙,氯化钙可以通过滴加碳酸钠溶液进行鉴别,有白色沉淀生成。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目