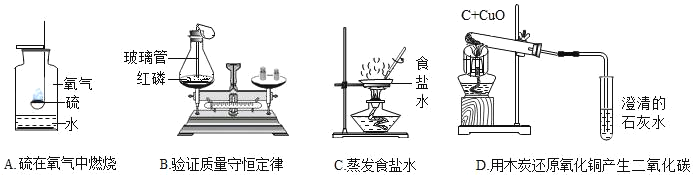
题目内容
【题目】2018年5月13日,我国首艘国产航母开始海试,标志着我国在航海及军事领域取得重大突破。
(1)建造航母的特种钢中含有金属钛,构成金属钛的粒子是_____(填“原子”、“分子”或“离子”),工业制钛有一种反应为:TiF4+2X=4HF+2SO3+TiO2,X的化学式为_____。
(2)特种钢是铁的一种合金,工业上可用赤铁矿和一氧化碳来炼铁,化学方程式为_____。
(3)航母外壳用涂料覆盖可以有效防止钢铁的锈蚀,原因是_____:除了防止金属的锈蚀以外,请再写一条保护金属资源的有效方法或途径_____。
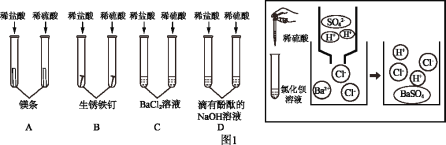
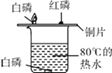
(4)为了探究航母材料中锌、铁、铜三种金属活动性强弱,某同学设计了下列实验方案,其中能达到目的是_____
A FeSO4溶液、Zn、Cu
B ZnSO4溶液、稀盐酸、Fe、Cu
C ZnSO4溶液、FeSO4溶液、Cu
D ZnCl2溶液、CuCl2溶液、Fe
【答案】原子 H2SO4 Fe2O3+3CO![]() 2Fe+3CO2 隔绝氧气和水 废旧金属回收再利用 ABD
2Fe+3CO2 隔绝氧气和水 废旧金属回收再利用 ABD
【解析】
铁与水和氧气同时接触时容易生锈,因此隔绝水和氧气可以防止铁制品生锈。
(1)构成金属钛的粒子是原子。由TiF4+2X=4HF+2SO3+TiO2可知,反应前后钛原子都是1个,氟原子都是4个,反应后氢原子是4个、硫原子是2个,氧原子是8个,反应前应该是氢原子是4个、硫原子是2个,氧原子是8个,包含在2X中,X的化学式为![]() 。
。
(2)高温条件下氧化铁和一氧化碳反应生成铁和二氧化碳,化学方程式为:
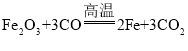 。
。
(3)航母外壳用涂料覆盖可以有效防止钢铁的锈蚀,原因是隔绝氧气和水;除了防止金属的锈蚀以外,废旧金属回收再利用也是保护金属资源的有效方法或途径。
(4)A、锌能和硫酸亚铁反应,说明锌比铁活泼,铜不能和硫酸亚铁反应,说明铁比铜活泼,故A正确;
B、铁、铜都不能和硫酸锌反应,说明锌比铁、铜活泼,铁能和稀盐酸反应,铜不能和稀盐酸反应,说明铁比铜活泼,故B正确;
C、铜不能和硫酸锌、硫酸亚铁反应,说明铜不如锌、铁活泼,但是无法判断锌和铁的活泼性,故C不正确;
D、铁不能和氯化锌反应,说明锌比铁活泼,能和氯化铜反应,说明铁比铜活泼,故D正确。故填ABD。

【题目】下列实验设计不能达到实验目的的是( )
选项 | A | B | C | D |
实验目的 | 除去CO中的CO2,并回收CO | 探究可燃物燃烧所需的条件 | 除去氧化铜粉末中的铜粉 | 鉴别NH4NO3、CuSO4和NaCl三种白色粉末 |
实验设计 |
|
|
|
|
A. AB. BC. CD. D
【题目】白云石粉是一种生产高级玻璃器皿、医药用瓶、光学玻璃的原料,某化学兴趣小组对白云石粉极其好奇,决定对其进行探究。
(查阅资料)白云石属于碳酸盐矿物,白云石粉主要成分的化学式可表示为:xMgCO3 ·yCaCO3。(杂质是二氧化硅,其不溶于水,也不与盐酸反应,受热不分解)
一、定性探究:白云石粉的成分和性质
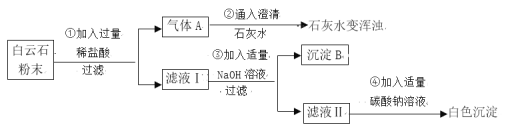
(实验分析)
(1)由步骤①②的现象可得出白云石粉中一定含有的离子是____________(填离子符号)。
(2)步骤③生成氢氧化镁的化学方程式是________________________________。该反应属于______(填写化学反应基本类型)。
(3)滤液Ⅱ中的溶质是_________________________。
(结 论)综合上述实验现象可初步证明白云石由碳酸钙、碳酸镁组成。
(实验质疑)小组同学经过讨论认为:因氢氧化钙微溶于水,导致沉淀B中除了氢氧化镁之外应该还混有氢氧化钙,对定量测定白云石粉的组成干扰较大,在老师的指导下该兴趣小组采用热分解法进行定量探究。
二、定量探究:白云石的组成
(查阅资料)碳酸钙开始分解的温度为898℃,1000℃时完全分解生成生石灰和二氧化碳气体;碳酸镁与碳酸钙的化学性质相似;碳酸镁开始分解的温度为540℃,700℃时完全分解。
(实验设计)为测定白云石中的含钙量及x:y的值,该兴趣小组设计了如下装置并进行实验:
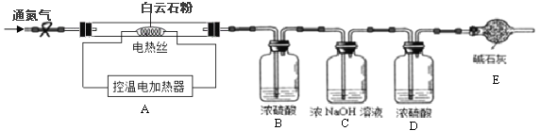
(实验步骤)①组装仪器,检查装置的气密性;②准确称取15.0g 白云石粉末放在A装置中,打开弹簧夹,鼓入一段时间氮气,称量B、C、D装置的质量;③关闭弹簧夹,打开控温电加热器,缓缓调升温度至700℃,持续加热至固体质量不变;④打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量;⑤关闭弹簧夹,调升温度至1000℃,持续加热至固体质量不变,打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量。
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | |
反应前 | 50.0 | 100.0 | 50.0 |
700℃ | 50.0 | 102.1 | 50.1 |
1000℃ | 50.0 | 106.3 | 50.3 |
(实验分析和数据处理)
(4)装置D的作用是______________;
(5)持续加热至固体质量不变后缓缓鼓入一段时间氮气的目的是_______________。
(6)计算白云石中碳酸镁的质量分数。(写出计算过程):_______________。
(7)设计实验证明白云石粉已完全分解的实验方法是_____________________________(写出实验方法、现象)
(8)白云石(xMgCO3 ·yCaCO3)中的 x:y=___________(最简整数比),若加热前没有鼓入一段时间的氮气,将会导致x:y的值________(填偏大、偏小或不变)。
【题目】同学们为了探究氢氧化钙的化学性质,做了如下实验:
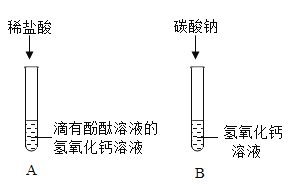
(1)试管A中观察到_____现象时,可证明氢氧化钙溶液与稀盐酸发生了反应。
(2)试管B中发生反应的化学方程式为_____;
(3)实验结束后,二支试管中的液体均为无色。同学们将二支试管中的无色液体倒入同一个洁净的烧杯中,静置一段时间,观察到烧杯底部有白色沉淀,上层溶液为无色。
[提出问题]无色溶液中除酚酞外还有哪些溶质?
[进行猜想]甲同学的猜想:NaCl
乙同学的猜想:NaCl、HCl
分析讨论]①经讨论,大家认为乙同学的猜想不正确,原因是_____;
②丙同学又提出了新的猜想,认为溶液中除氯化钠外,还可能含有_____,请你和丙同学一起验证他的猜想:
实验步骤 | 实验现象 | 实验结论 |
取少量无色溶液于试管_____ | _____ | 丙同学猜想正确 |
【题目】下表是氯化钠和硝酸钾在不同温度时的溶解度。
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度/g | 氯化钠 | 36.0 | 36.6 | 37.3 | 38.4 |
硝酸钾 | 31.6 | 63.9 | 110.0 | 169.0 | |
(1)两种物质中,溶解度的变化受温度影响较小的是_____。
(2)20℃时向100g水中加入25g氯化钠充分溶解,所得溶液中溶质的质量分数为_____。
(3)使接近饱和的硝酸钾溶液变为饱和溶液的一种方法是_____。
(4)60℃时,硝酸钾饱和溶液中溶有少量氯化钠,提纯硝酸钾的方法是_____。