��Ŀ����
����Ŀ������ͬѧ���Ķ��������ʱ��֪��ҵ���ƵõĴ����г�����һ������NaHCO3���������Ӽ���ȡ��ij������Ʒ����ͬѧ�ǽ���������̽�����
��ʵ��Ŀ�ģ�̽���ô�����Ʒ���Ƿ���NaHCO3��
���������ϣ�NaHCO3������ˮ����ˮ��Һ�ʼ��ԣ�����
�ֽ�����Na2CO3��CO2��H2O��NaHCO3����_____���������������������������������ʡ�
��ʵ����ƣ�����ͬѧ����ʵ��Ŀ��������������ַ�����
����1��ȡ����������ˮ�ܽ⣬��������Һ�еμӷ�̪��Һ���۲�����
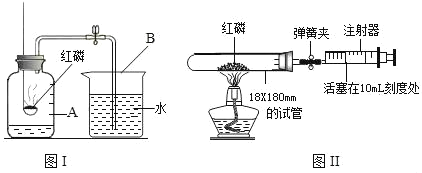
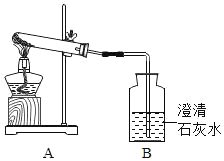
����2��ȡ�������������ͼ��ʾʵ��װ�õ��Թ��У����ȣ��۲�װ��B�е�����
��ǿͬѧ��Ϊ����1���ܴﵽʵ��Ŀ�ģ�����Ϊ����������_____��
������ʵ�飩������2����ʵ��ʱ���۲쵽װ��B�ڳ���ʯ��ˮ����ǣ��÷�Ӧ�Ļ�ѧ����ʽ��_____��
��ʵ����ۣ�����ʵ������˵���ô�����Ʒ��_____��������������������������NaHCO3��
�����۽���������ͬѧ�����÷���2�е�װ�����ⶨ�ô�����Ʒ��Na2CO3�ĺ������������Ҫ������շ�Ӧ���ɵ�CO2��Ϊ�ˣ�����Ϊװ��B�����ʢװ_____��Һ��
����չӦ�ã�����ȥNa2CO3�����л��е�NaHCO3������ķ�����_____��
���𰸡��� Na2CO3����ҺҲ��ʹ��̪��Һ��Ϊ��ɫ NaHCO3![]() Na2CO3+CO2+H2O ���� �������� ����
Na2CO3+CO2+H2O ���� �������� ����
��������
[��������]NaHCO3���н������Ӻ�������ӣ������� �������ʡ�
[ʵ�����]ȡ����������ˮ�ܽ⣬��������Һ�еμӷ�̪��Һ����Ϊ����1���ܴﵽʵ��Ŀ�ģ�������Na2CO3����ҺҲ��ʹ��̪��Һ��Ϊ��ɫ��
[����ʵ��]������NaHCO3������ˮ����ˮ��Һ�ʼ��ԣ������ֽ�����Na2CO3��CO2��H2O��������д��ѧ����ʽNaHCO3![]() Na2CO3+CO2+H2O��
Na2CO3+CO2+H2O��
[ʵ�����]����ʵ�������Ʋ�ô�����Ʒ�к���NaHCO3��
[���۽���]���� �������ơ��������Ƶ��ܽ��ԣ���֪����������Һ��Ũ�ȴʳ�����շ�Ӧ���ɵ�CO2��װ��B�����ʢװ ����������Һ��
[��չӦ��]������NaHCO3������ˮ����ˮ��Һ�ʼ��ԣ������ֽ�����Na2CO3��CO2��H2O��������ķ����� ���ȡ�

 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
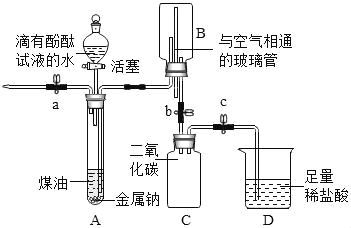
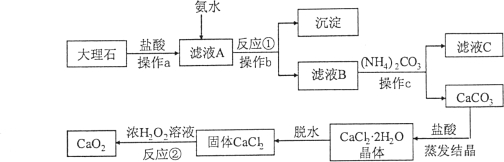
����һ������ܼƻ�ϵ�д�����Ŀ����֪��ú�Ͳ�������Ʒ�Ӧ��ú���ܶȱ�ˮС�Ҳ�����ˮ���������ڿ����м��ױ�����������������ˮ���ҷ�Ӧ�����������ƺ���������ѧ��ȤС��ͬѧ�������ͼ��ʾװ�ý���ʵ��̽�����й�ʵ������������¼���£�
���� | �� �� | �� �� |
�� | �ȴ�a���ٴ�Һ©�������� �����Թ�A�г���Һ������� �ر�a����Һ©������ | A��Һ��ֲ㣬�Ͳ����ϣ����۳�����ɫС�� ��Һ��Ľ��洦���ҷ�Ӧ�������������ݣ� �²���Һ�ʺ�ɫ��������B�� |
�� | ��b����B�в�����Һ����C ��ʱ�ر�b������a������ѹ | C����Һ�Գʺ�ɫ |
�� | ��ֹˮ��c | D����Һ����C�У��������ݣ���Һ��Ϊ��ɫ |
���й��ڸ�ʵ���˵����
�ٲ�����к�ɫ��Һ�ʼ��ԣ�������� ��ɫ��Һ������
�ڱ�ʵ��֤���˶�����̼��������������Ӧ
��װ��D���������Ȼ�����ҺҲ��ʵ��ʵ��̽����Ŀ��
�ܲ�����У�Cװ���ڷ����Ļ�ѧ��Ӧ��1��
��װ��B���������ͨ�IJ����ܵ�������ά��������ѹƽ�⣬ʹҺ��˳���ؽ���
����˵������ȷ���ǣ�������
A. �٢ڢ�B. �ڢۢ�C. �٢ܢ�D. �ڢܢ�