题目内容
【题目】(7分)过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域。下图是以大理石(含Al2O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图:
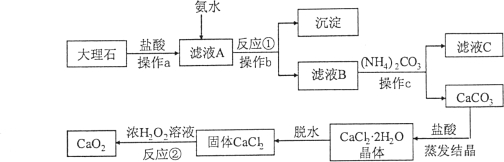
(1)操作a、b、c的名称都是 。
(2)操作a的目的是 。
(3)从滤液C中可回收的副产品的化学式为 。
(4)写出反应①的化学方程式 。
(5)反应②的基本反应类型是 。
(6)在该生产过程中,用110kg大理石制得了72Kg的过氧化钙。如果不考虑过程中的损耗,可计算出大理石中CaCO3的质量分数为 。(结果保留一位小数)
【答案】(1)过滤 (2)除去大理石中不溶于水也不溶于酸的杂质 (3)NH4Cl
(4)3NH3·H2O+AlCl3=Al(OH)3+3NH4Cl (5)复分解反应 (6)90.9%
【解析】
试题分析:(1)操作a、b、c均是将前面的物质分为滤液和不溶性固体两部分,所以操作的名称都是过滤。
(2)操作a为过滤,其作用是将不溶性固体和液体分离了。大理石与盐酸混合后,其中的不溶性固体是大理石中不溶于水也不溶于酸的杂质。所以操作的目的是除去大理石中不溶于水也不溶于酸的杂质。
(3)滤液B中含氯化钙和氯化铵。当加入碳酸铵时,氯化钙可与其反应生成碳酸钙沉淀和氯化铵。所以从滤液C中可回收的副产品为氯化铵,其化学式为NH4Cl。
(4)大理石中的Al2O3可与盐酸反应生成氯化铝,再加入氨水时,氯化铝可与其反应形成氢氧化铝沉淀。所以反应①的化学方程式为:3NH3·H2O+AlCl3=Al(OH)3+3NH4Cl。
(5)反应②中氯化钙可与浓过氧化氢溶液反应生成过氧化钙和盐酸,其基本反应类型是复分解反应。
(6)不考虑过程中的损耗,即大理石中CaCO3中的钙元素全部转化为过氧化钙。所以可根据钙元素的质量计算出碳酸钙的质量分数。大理石中CaCO3的质量为:72kg÷(![]() ×100%)×(
×100%)×(![]() ×100%)=100 kg。大理石中CaCO3的质量分数为:
×100%)=100 kg。大理石中CaCO3的质量分数为: ![]() ×100%=90.9%。
×100%=90.9%。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案