题目内容
【题目】将一小块银白色的金属钾放置在空气中会发生下列变化:
![]()
(提出问题)常温下钾与氧气反应产物有哪些?
(查阅资料)钾的氧化物,除氧化钾(K2O)外还有过氧化钾(K2O2),氧化钾与过氧化钾都能与水发生反应,化学方程式为![]() ;
;![]() 。
。
(猜想一)常温下钾与氧气反应的产物。
猜想1:K2O;
猜想2:K2O2;
猜想3:________________。
(实验探究一)
实验操作 | 实验现象 | 实验结论 |
取少量钾的氧化物加入足量蒸馏水 | ________________ | 猜想1正确 |
(继续探究)钾在空气中放置一段时间得到白色固体的成分。
(猜想二)猜想1:K2CO3;
猜想2:K2CO3和KOH。
(实验探究二)
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体加入足量_______________________ | 产生白色沉淀 | 白色固体成分为K2CO3和KOH |
②过滤,取少量滤液加入________________________ | _______ |
(实验反思)
类比氧化铁与盐酸的反应,写出氧化钾与盐酸反应的化学方程式:________________。
【答案】K2O和K2O2 若无气泡产生 CaCl2溶液 无色酚酞溶液 变红 ![]()
【解析】
[猜想一]
钾的氧化物,除氧化钾(K2O)外还有过氧化钾(K2O2),故猜想3: K2O和K2O2。
[实验探究一]
若猜想1正确,则加入足量蒸馏水生成氢氧化钾,没有气体产生,则填表如下:
实验操作 | 实验现象 | 实验结论 |
取少量钾的氧化物加入足量蒸馏水 | 若无气泡产生 | 猜想1正确 |
[实验探究二]
根据实验结论,若白色固体成分是碳酸钾,且产生白色沉淀,一定是加入了可溶性钙盐,操作②为验证氢氧化钾的存在,即验证氢氧根离子,可加入无色酚酞溶液,可观察到溶液变红。填表如下:
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体加入足量CaCl2溶液 | 产生白色沉淀 | 白色固体成分为K2CO3和KOH |
②过滤,取少量滤液加入无色酚酞溶液 | 变红 |
[实验反思]
氧化钾与盐酸反应生成氯化钾和水,其化学方程式为![]() 。
。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
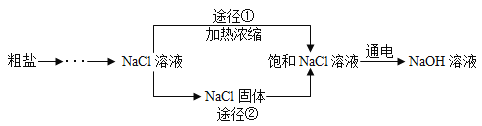
单元加期末复习先锋大考卷系列答案【题目】酸、碱、盐是初中化学学习的重要知识。根据所学知识,某化学兴趣小组设计了如下两个实验,探究氢氧化钠与二氧化碳的反应。
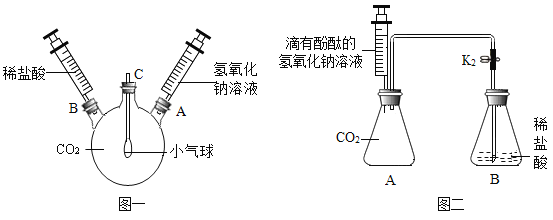
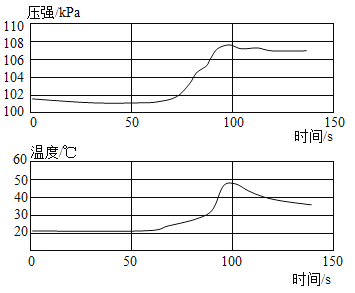
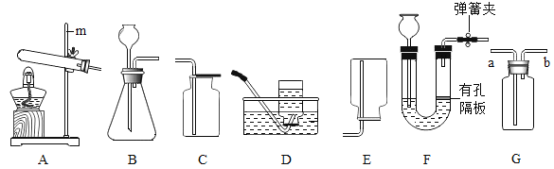
(1)如图一装置所示,先将氢氧化钠溶液注入三颈烧瓶中,然后再将稀盐酸注入三颈烧瓶中,观察到气球的变化是________________,产生这一现象的原因是_______________。
(2)根据实验一的原理,兴趣小组的同学又设计了图二装置。实验前关闭K,先将注射器中的氢氧化钠溶液注入A中,然后再打开K,稀盐酸倒流进A中,片刻后停止倒流,A中溶液仍为红色。同学们对反应后A装置中的溶液成分产生了兴趣,提出了如下猜想:
猜想一: NaCl、 Na2CO3
猜想二: NaCl、 NaOH
猜想三: NaCl、NaOH、Na2CO3
①上述猜想不合理的是___________,原因是______。
同学们经过讨论设计了如下实验方案进行探究
实验操作 | 实验现象 | 实验结论或化学方程式 |
②__________________ | 有白色沉淀产生 | ③反应的化学方程式__________ |
静置,取上层清液,向其中滴加酚酞溶液 | ④_________________ | 猜想三成立 |
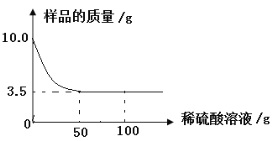
(3)上述实验结束后,兴趣小组的同学想将溶液的溶质都变为NaCl。他们向装置A中加入20g溶质质量分数为7.3%稀盐酸,恰好使红色完全退去,试计算反应后NaCl的质量增加了_______?