题目内容
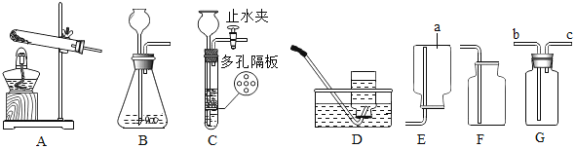
【题目】钢铁工业是一个国家工业化发展的支柱产业,如图是实验室和工业冶炼铁的示意图,某学校采用“问题探究式”课堂教学,从而解决问题,请你参与完成下列问题:
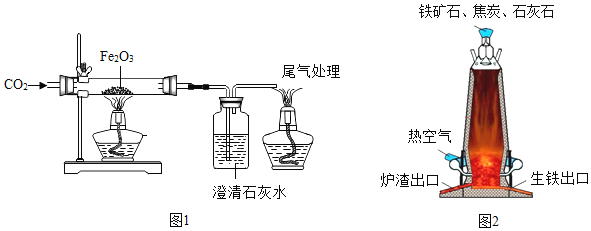
(1)实验时若先给氧化铁加热,再通一氧化碳可能产生的后果是_____;
(2)应对尾气处理的主要原因是_____;
(3)小明同学认为尾气可先储存在瓶内,然后再处理,如图3是他设计的贮气瓶。

①a、b两管应如何伸入,请将图补充完整_____;
②尾气应从_____(填“a”或“b”)端管口通入(其他装置略)。
(4)小刚同学提出质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入Fe2O3之前,应先通入澄清石灰水,以排除CO与澄清石灰水的反应,试对此作出评价。你认为小刚同学的设计是否有必要:_____,理由是_____。
(5)工业炼铁中焦碳的作用是_____。
(6)现将50吨含氧化铁80%的铁矿石与足量一氧化碳充分反应后,理论上可得到铁的质量多少_____。
【答案】爆炸 防止大气污染 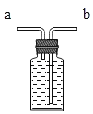 a 没必要 在加热前就先通入了一氧化碳,而此时一氧化碳与石灰水已经充分接触 先和氧气反应生成二氧化碳,再和生成的二氧化碳反应生成一氧化碳,一氧化碳再作为还原剂和铁矿石反应 28t
a 没必要 在加热前就先通入了一氧化碳,而此时一氧化碳与石灰水已经充分接触 先和氧气反应生成二氧化碳,再和生成的二氧化碳反应生成一氧化碳,一氧化碳再作为还原剂和铁矿石反应 28t
【解析】
(1)实验时由于装置内氧气,而一氧化碳具有可燃性,若先给氧化铁加热,再通一氧化碳可能产生的后果是 爆炸;
(2)由于一氧化碳有毒,所以应对尾气处理的主要原因是 防止大气污染;
(3)①由于是储气瓶,即气体留在瓶内而液体被压出,所以a、b两管应该如图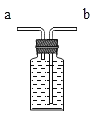 ;
;
②由于液体应该从长管流出,所以尾气应从a端管口通入。
(4)没必要,理由是 在加热前就先通入了一氧化碳,而此时一氧化碳与石灰水已经充分接触。
(5)工业炼铁中焦碳的作用是 先和氧气反应生成二氧化碳,再和生成的二氧化碳反应生成一氧化碳,一氧化碳再作为还原剂和铁矿石反应。
(6)现将50吨含氧化铁80%的铁矿石与足量一氧化碳充分反应后,理论上可得到铁的质量多少。
方法1:用化学方程式计算
设生成的铁的质量为x

x=28t
方法2:化学式计算
根据铁元素质量不变可得,生成的铁质量为50t×![]() ×100%=28t
×100%=28t
故答案为:
(1)爆炸;(2)防止大气污染;(3)①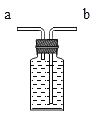 ;②a。(4)没必要; 在加热前就先通入了一氧化碳,而此时一氧化碳与石灰水已经充分接触。(5)先和氧气反应生成二氧化碳,再和生成的二氧化碳反应生成一氧化碳,一氧化碳再作为还原剂和铁矿石反应。(6)28t。
;②a。(4)没必要; 在加热前就先通入了一氧化碳,而此时一氧化碳与石灰水已经充分接触。(5)先和氧气反应生成二氧化碳,再和生成的二氧化碳反应生成一氧化碳,一氧化碳再作为还原剂和铁矿石反应。(6)28t。

【题目】已知氯化钾、硝酸钾在不同温度时的溶解度如下表,依据下表数据和溶解度曲线判断,下列说法错误的是
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | 氯化钾 | 27.6 | 34.0 | 40.0 | 45.5 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110.0 | |
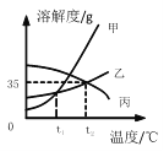
A. 能表示硝酸钾和氯化钾的溶解度曲线分别是甲和乙
B. t2℃时,将 15g 丙物质加入 50g 水中,形成溶液的质量是 65g
C. 氯化钾和硝酸钾的溶解度相等时的温度在 20℃至 40℃之间
D. 氯化钾中混有少量的硝酸钾,可采用降温结晶的方法提纯氯化钾
【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:
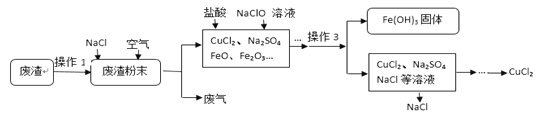
(1)操作1把废渣粉碎的目的 。
(2)在废渣粉末中加入NaCl和O2的目的是:CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,写出该反应的化学方程式 。
(3)【查阅资料】:不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
操作3的名称是 ,其中用到玻璃棒的作用是 。在此操作之前,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,你认为调节溶液的pH到 (填数值范围)比较合适。
(4)流程图中能循环利用的物质是 和水。