题目内容
【题目】用化学方法改造物质--“二氧化碳变汽油”二氧化碳是化石燃料燃烧的产物,汽油(主要成分为含有5个-11个碳原子的碳氢化合物)是全球用量最大的液体燃料.如果有人告诉你“二氧化碳能变成汽油”,你相信吗?
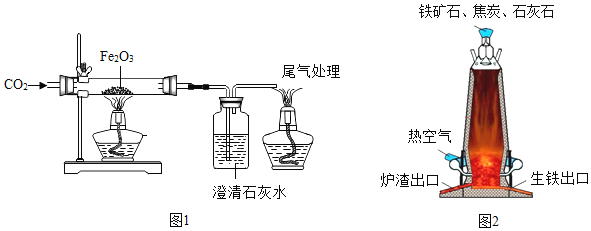
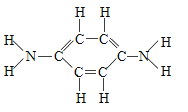
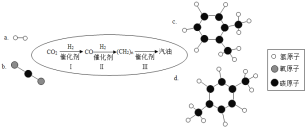
近日,中科院大连化学物理研究所研制出一种新型多功能复合催化剂,通过如图示意的I、II、III三个环节,将二氧化碳成功转化为汽油.(图中a、b是两种起始反应物的分子结构模型,c、d是最终制得的汽油中所含物质的分子结构模型)
请回答下列问题:
(1)要实现物质间的转化,往往需要有高效的催化剂.下列有关催化剂的叙述正确的是 ______(填字母编号).
A 催化剂可以改变化学反应速率
B 化学反应前后催化剂的质量不变
C 化学反应前后催化剂的化学性质发生改变
(2)在一定温度、一定压强和催化剂存在的条件下,环节I除生成CO外,还生成了一种化合物,则反应的化学方程式为CO2+H2![]() CO+H2O.该反应中,二氧化碳中的部分氧元素被氢气夺去,二氧化碳发生了__反应.
CO+H2O.该反应中,二氧化碳中的部分氧元素被氢气夺去,二氧化碳发生了__反应.
(3)从物质类别的角度看,环节II实现了无机物向___________ 的转变 .
(4)认真观察c和d两种物质的分子结构模型,试写出c物质的分子式C8H10,c和d的分子式是否相同?___________二者是否为相同物质?_____ ,d物质中碳元素和氢元素的质量比为 _______.
(5)“二氧化碳变汽油”的研究成果,使我国成为此领域的世界领跑者.你认为该成果的现实意义是_________________________(答出两条即可).
【答案】AB 有机物 相同 不是(或不相同) 48:5 有效降低CO2造成的温室效应 减少对传统化石能源的依赖
【解析】
(1)催化剂能改变化学反应的速率,而本身的质量和化学性质不变。
A、 催化剂可以改变化学反应速率,故A正确;
B、化学反应前后催化剂的质量不变,故B正确;
C、化学反应前后催化剂的化学性质不改变,故C错误。故选AB;
(2)二氧化碳中的部分氧元素被氢气夺去,二氧化碳发生了还原反应;
(3)从物质类别的角度看,环节II参加反应的物质是CO和H2,属于无机物,生成物是(CH2)n,属于有机物。实现了无机物向有机物的转化;
(4)c、d物质的分子式都是 C8H10,观察c和d两种物质的分子结构模型, c和d的分子式相同但不属于同种物质,属于同分异构体;d物质中碳元素和氢元素的质量比=(12×8):(1×10)=48:5;
(5)“二氧化碳变汽油”的研究成果,使我国成为此领域的世界领跑者,该成果的现实意义有效降低CO2造成的温室效应,减少对传统化石能源的依赖。

 阅读快车系列答案
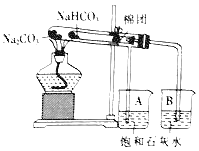
阅读快车系列答案【题目】某校化学兴趣小组对苏打(Na2CO3)和小苏打(NaHCO3)在生活中具有何作用、如何鉴别苏打和小苏打进行了如下的探究实验活动,请你参与他们的探究过程,并回答相关问题。
(查阅资料)
信息①相同条件下,碳酸钠溶液的碱性比碳酸氢钠溶的强;
信息②:NaHCO3在270℃时完全分解,会产生一种白色固体以及二氧化碳和水,而Na2CO3不易分解。
(实验过程)
(1)实验一:充分加热后,A、B两个烧杯中分别看到的现象是_____、_____,由此可得出的结论是_____。
(2)实验二:充分利用信息知识,区分无色Na2CO3溶液与NaHCO 3液最简单的方法是_____(填字母)。
A 加热 B 用pH试纸测碱性强弱 C 滴加稀盐酸
(实验反思)
(3)该装置设计的优点是_____。
(4)实验中应注意的问题是_____。
(5)可用小苏打治疗轻度胃酸(主要含盐酸)过多的病人,其原因是_____(用化学方程式进行说明)。
(注意:若答对(实验拓展)奖励4分,化学试卷总分不超过60分。)
(实验拓展)该兴趣小组的同学认为充分加热 NaHCO 3后的白色固体产物可能是NaOH或Na2CO3.请设计实验检验反应后的固体产物,并完成如表。限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管。
序号 | 实验操作 | 预期现象 | 结论 |
I | 取少量加热后的固体产物于试管A中,加入适量的蒸馏水,充分振荡、溶解,再加入足量的_____,振荡、静置 | 产生白色沉淀 | 产物含Na2CO3 |
Ⅱ | 少量操作后的上层清液于试管B中,滴加_____ | _____ | 产物不含NaOH |
【题目】某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 8 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量为_____g:
(2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数_______。(写出计算过程,最终结果保留0.1%)。