题目内容
【题目】为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:
①在三个烧杯中分别加入12.0g样品及足量的水配成溶液;
②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;
③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入10.0%氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
请回答:
(1)12g样品中生成沉淀________g。
(2)样品中碳酸钠的质量分数是________?(写出计算过程,结果精确到0.1%)
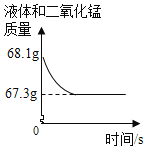
(3)在如图中绘制出白色沉淀与加入氯化钙溶液的质量关系图___________(图上要注明白色沉淀、氯化钙溶液的相关质量)。
【答案】10 88.3% 
【解析】
解:(1)由表格可知,加入10.0%氯化钙溶液的质量为120g以后,白色固体的质量为10g不在增加,所以12g样品中生成沉淀的质量为10g。故填:10;
(2)设样品中碳酸钠的质量是x
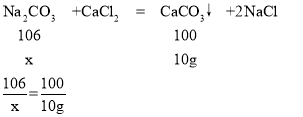
x=10.6g
样品中碳酸钠的质量分数是:![]()
答:样品中碳酸钠的质量分数88.3%。
(3) 根据图表信息可以知道比较烧杯Ⅰ和烧杯Ⅱ中的数据可以知道,55.5g氯化钙溶液可以和碳酸钠反应生成5.0g沉淀,那么产生10.0g沉淀,所需氯化钙溶液的质量为111.0g,可以据此作图为: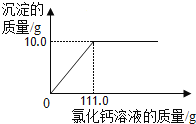 。
。

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目