题目内容
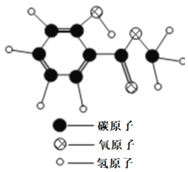
【题目】如图为某化学反应的微观过程,其中“![]() ”和“
”和“![]() ”表示两种不同原子。
”表示两种不同原子。
![]()
(1)该反应属于_____(填基本反应类型)反应。
(2)虚线框内应填的微观图示是_____(选填A、B、C、D),你推断的依据是_____。
A. ![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)写出符合该微观示意图的一个具体反应的化学方程式:_____。
【答案】分解 D 化学反应前后元素种类不变,原子个数不变 2H2O![]() 2H2↑+ O2 ↑
2H2↑+ O2 ↑
【解析】
本题考查的是质量守恒定律及其应用。
(1)根据反应类型的特点进行分析,由化学反应的微观图可以看出,该反应是一种化合物分解成两种化合物的反应,符合分解反应的特征,属于分解反应;
(2)根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变,可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同,由此可推断化学反应方程式中反应物或生成物的化学式。
由化学反应的微观图可以看出,反应前的物质中共有2个“![]() ”原子和4个“
”原子和4个“![]() ”原子,而生成物中只有4个“
”原子,而生成物中只有4个“![]() ”原子,缺少2个“
”原子,缺少2个“![]() ”原子,根据质量守恒定律,虚线框内应填的微观图示是D。
”原子,根据质量守恒定律,虚线框内应填的微观图示是D。
(3)符合该微观示意图的一个具体反应的化学方程式为:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑

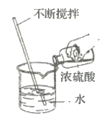
【题目】某化学兴趣小组学习了酸、碱、盐的知识后,对某些盐的性质开展了探究活动。
研究主题;探究FeCl3溶液加热,灼烧的变化
相关信息:酒精(C2H5OH)具有还原性,加热条件下能与Fe3O4反应;Fe和Fe3O4易被磁铁吸引,FeO是一种黑色固体,不能被磁铁吸引;Fe3O4能与盐酸反应,生成盐和水。
(1)实验一:将大约20mL饱和FeCl3溶液在蒸发皿中加热蒸发,沸腾后发现溶液中逐渐产生红褐色浑浊。
①FeCl3溶液呈黄色主要是因为溶液中含有铁离子,铁离子符号为_______。
②加热时,FeCl3易与水反应生成红褐色物质和盐酸,反应的化学方程式:________。
③由实验启示,FeCl3溶液通过蒸发结晶的方式______(填“能”或“不能”)获得FeCl3固体。
(2)实验二:将实验一蒸发获得的红褐色固体转移到坩埚中灼烧,颜色由红褐色变为红棕色。
①此过程发生分解反应,除生成红棕色物质外,还生成水,反应的化学方程式:_____。
②氢氧化镁、氢氧化铜等加热分解也能得到对应的金属氧化物,结合实验,从物质类别及其溶解性推断,通过加热分解_____________可生成对应的金属氧化物。
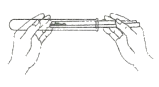
(3)实验三:小组同学用多根玻璃棒蘸取饱和FeCl3溶液于酒精灯火焰上灼烧,随着加热时间的持续,在1分钟内观察到玻璃棒表面颜色的变化依次为:黄色、红褐色、红棕色、黑色。
①实验三相对于实验一和二,优点是______(答1点即可)
②同学们对黑色物质的成分产生了疑问。联系酒精的可燃性、还原性等相关性质,对黑色物质的成分提出了猜想,经讨论认为,可能是____________(名称也可)和Fe3O4四种物质中的一种或几种。
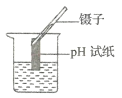
③为了确定黑色物质的成分,收集黑色物质,进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取黑色粉末用磁铁吸引,观察现象 | 黑色粉末全部被磁铁吸引 | 综合实验现象判断,此黑色物质成分是____________ |
向装有黑色粉末的试管中加入足量的盐酸,充分反应,观察现象 | 固体逐渐溶解,但无气泡产生 |
(4)拓展延伸
①配制FeCl3溶液时,为防止出现红褐色物质,可向其中滴加少量的______________(化学式也可)溶液。
②结合已学知识,从元素化合价变化的角度分析,Fe2O3发生还原反应时,反应前后铁元素化合价一般呈_________(填“上升”或“下降”)的变化。