题目内容
【题目】海洋化学资源的综合利用将是威海重点发展领域之一。海洋为我们提供各种所需的物质:
A:能通过物理方法获取的物质
(1)海水淡化:蒸馏法淡化海水是利用海水中各成份的_________不同分离出淡水,用化学方法证明得到的水是淡水,其中涉及到的原理用化学方程式表示________。膜法利用了增加海水一端压强促使淡水穿过淡化膜的原理,则用于淡化海水的膜在结构上应具有的特点___________。
(2)海水“晒盐”:①制粗盐。从海水获取粗盐用的结晶方法是_______,采用该方法是依据了氯化钠的性质_______。为了更有效地从海水中提取粗盐,大规模海水“晒盐”过程中,采取了什么措施(写一条即可)________,微观角度解释风吹日晒有利于晒盐的原因是_________。
②粗盐纯化。粗盐中含有泥沙、硫酸钠等杂质。将粗盐溶于水,然后通过如下操作,即可得到较纯的氯化钠(每步操作只用一次,不是每步操作都必须使用):
a 过滤 b 加过量的![]() 溶液 c 加适量的盐酸 d 加过量的
溶液 c 加适量的盐酸 d 加过量的![]() 溶液 e 蒸发结晶 f 加过量的
溶液 e 蒸发结晶 f 加过量的![]() 溶液
溶液
正确的操作顺序是_________(填字母)。过程中,发生的化学反应方程式为:__________
(拓展应用)自然界中的物质绝大多数都是混合物,提取某种物质,首先要考虑这种物质的物理性质。例如:草木灰中含有碳酸钾(杂质不溶于水),要从中提取碳酸钾,应经过的实验步骤依次是______、_____、_______。每一步都需要用到的玻璃仪器是______,它在最后一步中的作用是__________。
B:利用化学方法制取物质——化学工业的核心
①化工行业选择原料时,通常需要考虑下列____________因素等。
A 能不能通过化学反应生成所需物质 B 原料来源是否广泛,是否廉价易得
C 是否能与氧气反应 D 是否含有所得物质中的元素
②海洋中有丰富的水生生物和化学资源。海水晒盐后,以其母液(卤水)和贝壳为原料,还可生产具有特殊用途的材枓——纳米氧化镁,其简要流程如下:

实验室进行a操作时,要的玻璃仪器有__________。其中属于复分解反应的化学方程式是_________。由滤渣生产纳米氧化镁的过程中,若只发生一个化学反应,则最有可能是________(填序号)
A 化合反应 B 分解反应 C 置换反应 D 复分解反应
(3)制碱:氨碱法制纯碱的流程图如下:
![]()
完成图中括弧里的内容:①________,②________,③_______。该过程的化学反应方程式有__________。
【答案】沸点 NaCl+AgNO3=AgCl↓+NaNO3 膜的空隙能让水分子通过,而不让盐离子通过 蒸发结晶 氯化钠溶解度受温度影响不大 选择大面积平坦的海边 加速分子运动 bdace Na2SO4+BaCl2=BaSO4↓+2NaCl、 Na2CO3+BaCl2=BaCO3↓+2NaCl、Na2CO3+2HCl═2NaCl+H2O+CO2↑ 溶解 过滤 蒸发 玻璃棒 搅拌,使液体受热均匀,防止液体飞溅 ABD 烧杯、漏斗、玻璃棒 Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓ B 氨气 二氧化碳 加热 NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl、2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
A:能通过物理方法获取的物质
(1)海水淡化:蒸馏法淡化海水是利用海水中各成份的沸点不同分离出淡水;用化学方法证明得到的水是淡水,即证明不含有氯化钠,用硝酸银和氯化钠反应生成氯化银沉淀和硝酸钠的反应检验,其中涉及到的原理用化学方程式表示NaCl+AgNO3=AgCl↓+NaNO3;膜法利用了增加海水一端压强促使淡水穿过淡化膜的原理,则用于淡化海水的膜在结构上应具有的特点膜的空隙能让水分子通过,而不让盐离子通过。
(2)海水“晒盐”:①制粗盐。从海水获取粗盐用的结晶方法是蒸发结晶;采用该方法是依据了氯化钠溶解度受温度影响不大的性质;为了更有效地从海水中提取粗盐,大规模海水“晒盐”过程中,可以采取选择大面积平坦的海边的措施;微观角度解释风吹日晒有利于晒盐的原因是加速分子运动。
②粗盐纯化。粗盐中含有泥沙、硫酸钠等杂质。将粗盐溶于水,然后通过如下操作,即可得到较纯的氯化钠(每步操作只用一次,不是每步操作都必须使用):
正确的操作顺序是b 加过量的![]() 溶液除去硫酸钠, d 加过量的
溶液除去硫酸钠, d 加过量的![]() 溶液除去过量的氯化钡,a 过滤除去反应生成的硫酸钡沉淀和碳酸钡沉淀,c 加适量的盐酸除去过量的碳酸钠溶液,e 蒸发结晶得到氯化钠晶体,故填: bdace;该过程中,发生的化学反应方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl、 Na2CO3+BaCl2=BaCO3↓+2NaCl、Na2CO3+2HCl═2NaCl+H2O+CO2↑;
溶液除去过量的氯化钡,a 过滤除去反应生成的硫酸钡沉淀和碳酸钡沉淀,c 加适量的盐酸除去过量的碳酸钠溶液,e 蒸发结晶得到氯化钠晶体,故填: bdace;该过程中,发生的化学反应方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl、 Na2CO3+BaCl2=BaCO3↓+2NaCl、Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(3)自然界中的物质绝大多数都是混合物,提取某种物质,首先要考虑这种物质的物理性质。例如:草木灰中含有碳酸钾(杂质不溶于水),要从中提取碳酸钾,应经过的实验步骤依次是溶解(碳酸钾溶于水,杂质不溶于水)、过滤(除去杂质)、蒸发(得到碳酸钾)。每一步都需要用到的玻璃仪器是玻璃棒,它在最后一步中的作用是搅拌,使液体受热均匀,防止液体飞溅。
B:利用化学方法制取物质——化学工业的核心
①化工行业选择原料时,通常需要考虑:能不能通过化学反应生成所需物质;原料来源是否广泛,是否廉价易得;是否含有所得物质中的元素因素等。故填ABD;
②海洋中有丰富的水生生物和化学资源。海水晒盐后,以其母液(卤水)和贝壳为原料,还可生产具有特殊用途的材枓——纳米氧化镁,其简要流程如下:
实验室进行a操作时,该操作是过滤,需要的玻璃仪器有烧杯、漏斗、玻璃棒。其中属于复分解反应是氢氧化钙和氯化镁反应生成氢氧化镁和氯化钙,化学方程式是Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓。由滤渣生产纳米氧化镁的过程中,若只发生一个化学反应,则最有可能是氢氧化镁分解得到氧化镁,故填B。
(4)精盐水通入氨气得到饱和氨盐水,饱和氨盐水通入二氧化碳得到碳酸氢钠,碳酸氢钠加热得到碳酸钠,故图中括弧里的内容是:①氨气②二氧化碳③加热(合理即可);该过程的化学反应方程式有NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl ;2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。

【题目】为了测定某品牌纯碱(杂质为氯化钠)中碳酸钠的质量分数,进行了如下实验:
①在三个烧杯中分别加入12.0g样品及足量的水配成溶液;
②向三个烧杯中分别加入一定质量的10.0%氯化钙溶液;
③将充分反应后生成的沉淀过滤、洗涤、干燥,并称量得到的白色固体。
实验所得数据见下表:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | |
加入10.0%氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
白色固体的质量(g) | 5.0 | 10.0 | 10.0 |
请回答:
(1)12g样品中生成沉淀________g。
(2)样品中碳酸钠的质量分数是________?(写出计算过程,结果精确到0.1%)
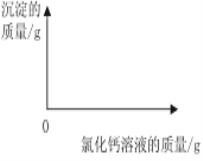
(3)在如图中绘制出白色沉淀与加入氯化钙溶液的质量关系图___________(图上要注明白色沉淀、氯化钙溶液的相关质量)。