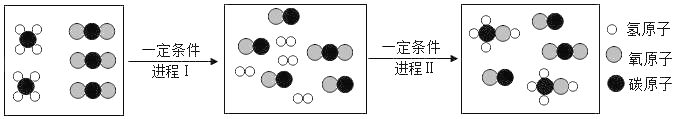
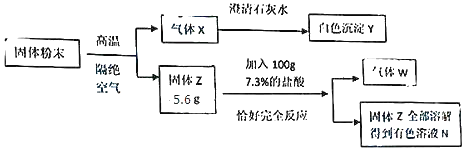
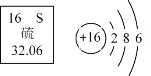题目内容
【题目】为测定某样品中碳酸氢钠(![]() )的含量,进行如下实验:取
)的含量,进行如下实验:取![]() 样品放于烧杯中,向烧杯中滴加盐酸(反应的化学方程式是
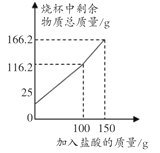
样品放于烧杯中,向烧杯中滴加盐酸(反应的化学方程式是![]() ,杂质不与盐酸反应,整个过程不考虑盐酸的挥发和气体的溶解),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。求:
,杂质不与盐酸反应,整个过程不考虑盐酸的挥发和气体的溶解),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。求:
(1)产生![]() 的总质量为_____________g。
的总质量为_____________g。
(2)样品中碳酸氢钠的质量分数_____________。
【答案】![]() 解:样品中碳酸氢钠质量为
解:样品中碳酸氢钠质量为![]() 。
。
![]()
84 44
x 8.8g
![]() ,得
,得![]()
样品中碳酸氢钠的质量分数为![]()
答:该样品中碳酸氢钠的质量分数为![]() 。
。
【解析】
解:(1)加入100g盐酸后再加入50g稀盐酸,导致总质量也增加166.2g-116.2g=50g,说明加入100g稀盐酸时已经完全反应。根据质量守恒定律可得,生成的二氧化碳的质量为25g+100g-116.2g=8.8g。
(2)设样品中碳酸氢钠质量为![]() ,
,
![]()
84 44
x 8.8g![]()
得![]()
样品中碳酸氢钠的质量分数为![]() ,
,
答:(1)产生CO2的总质量为 8.8g;(2)样品中碳酸氢钠的质量分数为67.2%。

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目