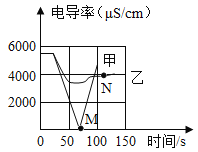
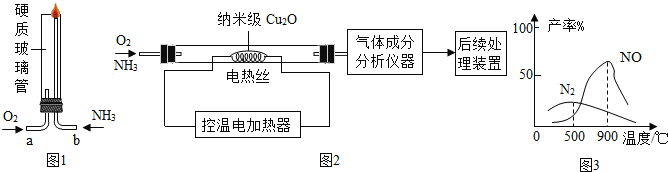
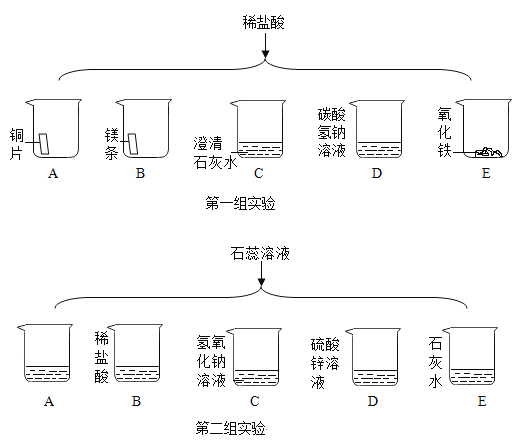
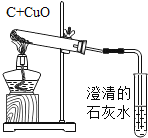
题目内容
【题目】为了测定大理石样品中钙元素的质量分数(杂质不含钙元素,不溶于水,也不与其他物质发生反应),进行了如下实验。请回答下列问题。
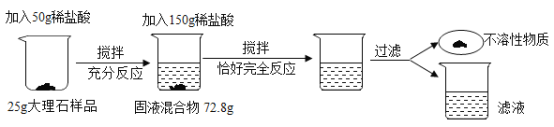
(1)上述实验过程中发生反应的化学方程式为____________________。
(2)根据已知条件列出求解第一次所加的稀盐酸中溶质的质量(x)的比例式__________________。
(3)此大理石样品中钙元素的质量分数__________________。
(4)用36.5%的浓盐酸配制200g上述稀盐酸,所需盐酸的质量为__________________。
(5)若将反应后的滤液蒸发11.2g水,无晶体析出,所得溶液中溶质的质量分数为______________。
(6)现有上述大理石样品500t,可以制得含杂质的生石灰的质量为__________________。
【答案】![]()
![]() 32% 40g 11.1% 324t
32% 40g 11.1% 324t
【解析】
(1)盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,书写化学方程式注意配平及气体符号;
故填:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)解:第一次50g稀盐酸完全反应生成二氧化碳为50g+25g-72.8g=2.2g,
设第一次所加的稀盐酸中溶质质量为x
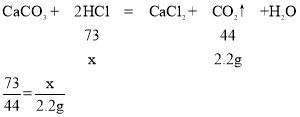
故填:![]() 。
。
(3)根据(2)中比例式,可以求得x=3.65g,加入150g稀盐酸,与之前的50g稀盐酸相同,所以150g稀盐酸中含有溶质的质量=3.65g×3=10.95g,稀盐酸一共含有溶质=10.95g+3.65g=14.6g,设样品中碳酸钙质量为m,
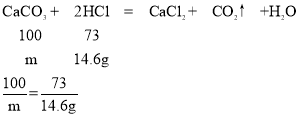
m=20g
其中钙元素质量=20g×![]() ×100%=8g,所以样品中钙元素质量分数=
×100%=8g,所以样品中钙元素质量分数=![]() ×100%=32%
×100%=32%
答:此大理石样品中钙元素的质量分数为32%。
故填:32%。
(4)用36.5%的浓盐酸配制200g上述稀盐酸,设所需盐酸的质量为a
a×36.5%=14.6g
a=40g
答:所需盐酸的质量为40g。
故填:40g。
(5)设反应生成二氧化碳质量为y,生成氯化钙质量为z,
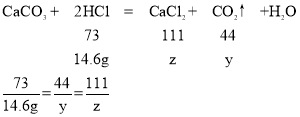
y=8.8g z=22.2g
所以滤液质量=200g+20g-8.8g=211.2g,此时蒸发11.2g水,溶液质量变为=211.2g-11.2g=200g
所以所得溶液中溶质的质量分数为![]()
答:所得溶液中溶质的质量分数为11.1%。
故填:11.1%。
(6)设生石灰质量为c,样品中碳酸钙质量分数=![]() ×100%=80%,所以此时碳酸钙质量=500t×80%=400t,
×100%=80%,所以此时碳酸钙质量=500t×80%=400t,
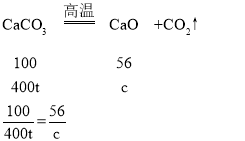
c=224t
杂质质量=500t-400t=100t,所以生成含杂质的生石灰质量=100t+224t=324t
答:可以制得含杂质的生石灰的质量为324t。
故填:324t。

【题目】分类、类比是初中化学常用的学习方法。初中化学有许多实验,若按照实验主要目的可将实验分为:物质发生化学反应条件的探究,物质性质的探究,物质含量的探究等。按实验目的将下列实验中的B与______(填字母)归为一类,分类的依据是______。
|
|
|
|
A | B | C | D |
(2)![]() 年,俄国学者贝开托夫
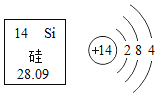
年,俄国学者贝开托夫![]() 在实验的基础上,根据金属和金属离子间互相置换的大小,以及金属跟酸、水等反应的剧烈程度,首先确定了金属活动性顺序,在这个顺序里包括了氢。在金属活动性顺序中活动性越强,其金属的还原性也越强。确定金属的活动性也可以根据元素在元素周期表中的位置判断,如图是元素周期表的一部分。请回答下列问题。
在实验的基础上,根据金属和金属离子间互相置换的大小,以及金属跟酸、水等反应的剧烈程度,首先确定了金属活动性顺序,在这个顺序里包括了氢。在金属活动性顺序中活动性越强,其金属的还原性也越强。确定金属的活动性也可以根据元素在元素周期表中的位置判断,如图是元素周期表的一部分。请回答下列问题。
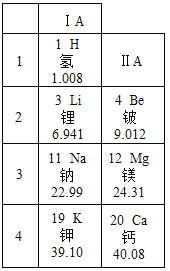
金属活动性顺序为:![]()
请推断金属铍的金属活动性比金属镁的活动性______(填“强”或“弱”);金属锂的还原性比金属镁的活动性______(填“强”或“弱”)。